Физические свойства воды. Физические свойства воды
Физические свойства воды
Поиск ЛекцийКраткий текст лекции на тему
«Строение молекулы воды. Её физические и химические свойства»
Вода - драгоценный дар природы, которую академик Карпинский назвал живой кровью, которая создает жизнь там, где ее не было.
«Вода стоит особняком в истории нашей планеты, Нет природного тела, которое могло сравниться с ней по влиянию на ход основных, самых грандиозных геологических процессов» (В.И.Вернадский).
Формула воды - Н2О (предложена в 1805 г Гумбольдтом и Гей-Люсаком), т.е. состоит из 1 атома кислорода и 2-х атомов водорода .
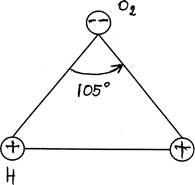 1). Молекула воды асимметрична, образует равнобедренный треугольник.
1). Молекула воды асимметрична, образует равнобедренный треугольник.
2). Молекула воды обладает полярностью, поэтому является электрическим диполем.
3). Молекулярная структура воды: вода находится в трех состояниях и осуществляет фазовые переходы.
Гидроль (пар) - состоит из одиночных молекул Н2О, поэтому водородные связи не реализуются; (Н2О)
Дигидроль (жидкость) - строение как у льда, а пустоты заполнены одиночными молекулами; (2Н2О) Тригидроль (лёд) - упорядоченное строение, гексагональная система с прочными водородными связями, имеет наибольший объем. (3Н2О)
4) Водородные связи в 10 раз прочнее, чем связи межмолекулярного взаимодействия.
5) В 1932 г. Юри и Осборн открыли, что водород и кислород имеют природные изотопы, т.е. вода имеет переменный изотопный состав и
атомы вещества с разной молекулярной массой. -
Н=1 – Н20 - протий - «легкая, живая вода», талая вода;
Н=2 - D2O - дейтерий- «тяжелая, мертвая вода», содержащая соли тяжелых металлов;
Н=3 - Т2О - тритий - «сверхтяжелая вода», образующаяся при термоядерных реакциях.
Химически чистая вода состоит по весу из 11,19% водорода и 88,81 % кислорода.
Физические свойства воды
1). Молекулы воды осуществляют переходы из одного состояния в другое (фазовые переходы). Переходы сопровождаются выделением или поглощением энергии (скрытая теплота парообразования) Испарение - из жидкости в пар - поглощение тепла. Конденсация - из пара в жидкость - выделение тепла. Замерзание - из жидкости в лед - выделение тепла. Таяние - из льда в жидкость - поглощение тепла.
Возгонка - из льда в пар (испарение с поверхности льда)- поглощение тепла. Сублимация - из пара в лед (конденсация в твердую фазу), например, иней- выделение тепла. При увеличении температуры воды скрытая теплота парообразования уменьшается.
2). При нормальном давлении температура плавления льда и замерзания воды равна 0°С. При повышении давления лед плавится при отрицательных температурах.
3). С увеличением солености понижается температура замерзания воды. Следует помнить, что при увеличении солености на 10%о температура замерзания воды понижается на 0,54°С.
4). Плотность воды в твердом состоянии меньше, чем в жидком. Следовательно, лед образуется на поверхности водоемов и не опускается на дно.
5). В диапазоне температуры воды от 0 до 4°С плотность воды не уменьшается, а увеличивается. Это аномальное свойство воды, вследствие которого образуется лед и водоемы не промерзают, потому что при температуре воды менее 4°С пресная вода становится менее плотной.
6). Аномальное изменение плотности приводит к аномальному изменению объёма воды. С увеличением температуры от 0 до 4°С объём химически чистой воды уменьшается; лишь при дальнейшем увеличении температуры объём увеличивается.
Объём льда всегда больше объема воды. Примеры в природе - морозное выветривание, образование наледей, бугров бучения и т.д.
7). Высокая удельная теплоемкость воды (ср). ср при 15°С = 4190 Дж/кгС0.
срминимальна при температуре равной 33°, увеличивается при увеличении и уменьшении температуры. Высокая сри очень высокая удельная температура плавления и испарения, что ведет к регулированию тепловых процессов на всей планете.
8). Очень малая теплопроводность. При понижении температуры и давления понижается и теплопроводность. С понижением температуры и понижением плотности уменьшается теплопроводность. Поэтому происходит медленный нагрев и охлаждение водной массы. Проявляется это свойство в том, что снег предохраняет почву от промерзания, а лед - водоемы от промерзания.
9). Вязкость воды невелика, поэтому вода подвижна. При увеличении температуры вязкость уменьшается, поэтому в холодное время года вязкость воды больше, чем в теплое.
10). Очень высокое поверхностное натяжение. Поэтому происходит:
• размыв фунтов водой;
• очень большая разрушительная деятельность дождевых капель;
• перемещение воды по порам и капиллярам в земной коре.
11). Свет частично поглощается и преломляется, поэтому проникает лишь на небольшую глубину. Именно здесь протекает фотосинтез.
12). Вода хорошо проводит звук (в 4-5 раз больше, чем в воздухе). Скорость звука увеличивается при повышении температуры воды, солености и давления.
13). Низкая электропроводность, которая увеличивается при повышении минерализации количества ионов хлора и калия.
poisk-ru.ru
Физические свойства воды
(по К.С. Лосеву)
Если кому-то из нас задать вопрос, что такое вода, то первой реакцией будет удивление, а второй - скорее всего формула Н2О. Потом, наверное, последует разъяснение о том, что вода - это широко распространенное вещество и к тому же крайне полезное, но в целом в нем нет ничего особенного. Действительно, что может быть проще Н2О? Два атома водорода соединены с одним атомом кислорода. Трудно поверить в необыкновенность, а тем более таинственность такого, казалось бы, обыкновенного соединения. Но, оказывается, воде свойственны и необыкновенность, и таинственность.
Анализ обыкновенной воды показывает, что на самом деле это смесь нескольких разновидностей воды с общей формулой Н2О, представляющих собой соединения изотопов кислорода и водорода. Кроме обычного водорода в природе встречается водород с массой 2, называемый дейтерий (D), и еще более тяжелый водород с массой 3, называемый тритий (Т). У кислорода выявлены, кроме обычного с атомным весом 16, еще два более тяжелых изотопа: с атомными весами 17 и 18.
Теоретически может существовать 42 разнообразных изотопных разновидностей воды, из которых только 7 устойчивы, т. е. не радиоактивны. Однако пока обнаружены далеко не все разновидности воды. Вот их-то смесь и образует реальную гидросферу. 99,73% гидросферы состоит из обычной воды с молекулярным составом h3О16. Еще 0,04% - это тяжелокислородная вода с составом Н2О17 и 0,02% - вода с составом Н2О18. Доля тяжелой воды с составом DO2 в природных водах составляет в среднем 1/6800, или примерно 0,15 мл на 1 л природной воды.
Разница в изотопном составе сказывается на физических свойствах воды. Так, тяжелая вода имеет плотность 1,104 г/см3, кипит при 101,43°С, а лед из тяжелой воды плавится при 3,813 °С. Тяжелая вода испаряется медленнее, чем обыкновенная, и, может быть, поэтому в некоторых замкнутых водоемах происходит обогащение тяжелой водой. Эксперименты показывают, что она угнетает растения, а в больших дозах даже вызывает их гибель. В общей массе природной воды влияние изотопных разновидностей на физические свойства неощутимо или пока достаточно не выяснено.
При О °С вода состоит из мономеров Н2О только частично, большая же ее часть при этой температуре состоит из тримеров (Н2О)3, в то время как при температуре 4 С основную массу воды составляют димеры (Н2О)2. Как бы ни было велико число изотопов, казалось бы, что изучение любой жидкости (а их много) тем труднее, чем сложнее ее химический состав. С этой точки зрения, вода, имеющая простой состав, должна быть познана гораздо лучше любой другой жидкости более сложного состава. Однако именно в отношении воды это оказалось не так.
Во второй половине прошлого века Д. И. Менделеев, демонстрируя возможности созданной им системы химических элементов, предсказал существование еще не известных науке элементов, а также свойств этих элементов и их соединений, в соответствии со сформулированным им законом: "свойства химических элементов в образуемых ими простых и сложных соединениях находятся в периодической зависимости от величины молекулярной массы".

Аномалия точек кипения и замерзания воды в сравнении с другими соединениями водорода, обладающими похожей молекулярной структурой. Справа налево прослеживается плавный ход кривых, соединяющих точки кипения и замерзания соединений водорода с теллуром, селеном и серой. Дальше кривые круто взлетают вверх, так как температура замерзания воды вместо ожидаемой -90°С составляет 0°С, а температура кипения вместо ожидаемой -70°С равна +100°С.
Аналогом кислорода по таблице Менделеева служит ряд: сера (S), селен (Se), теллур (Те). Их соединения с водородом, подобные воде, называют гидратами: h3S, h3Se и Н2Те. Заряд ядра определяет физические свойства веществ этого ряда. Действительно, если Н2Те - вещество с самым тяжелым молекулярным весом этого ряда - кипит при -4 °С, а замерзает при -51 °С, то два других, более легких, соединения (h3Se и h3S) кипят и замерзают при более низкой температуре, прямо пропорциональной их молекулярным весам. Но самое легкое из этого ряда соединений - вода - не признает никаких закономерностей: она должна была бы замерзать при -90°С, а она замерзает при 0°С, кипеть при -70°С, а она кипит при 100°С. Как выяснилось, воды, отвечающей законам, которым подчиняются все вещества такого же ряда, не существует. Окружающая нас вода - это вещество с Уникальными свойствами, которые не только еще полностью не объяснены, но наверняка далеко не все известны. Вспомним хотя бы дискуссии об омагниченной воде или опыты с талой водой.
Не будем ставить под сомнение закон. Вода - редчайшее, а может быть уникальное, исключение из правил. Пожалуй, нет вещества более удивительного и загадочного, чем обыкновенная вода. Но объяснить до конца причины этого пока не удается, хотя понятно, что загадки воды спрятаны в строении ее молекулы и межмолекулярной структуре.
Может быть, все особенности воды определяются теми химическими элементами, которые ее образуют, - кислородом и водородом. Элементы эти простые, но весьма распространенные на Земле и в космосе. Отличает их от многих других элементов большое своеобразие. Прежде всего это можно сказать о водороде - элементе, который не имеет даже одной заполненной, а потому устойчивой, электронной оболочки. Чтобы она была устойчива, ему нужен еще один электрон. Простота его строения - один протон и один электрон - обеспечивает ему особые свойства. Хотя положительный заряд его ядра равен отрицательному заряду электрона, один атом водорода тем не менее проявляет способность притягивать некоторые другие атомы. Иными словами, соединившись с другим атомом, например кислорода, с помощью своего единственного электрона, он получает еще некоторую дополнительную способность притяжения, возможность создания так называемых водородных связей. Эта особенность определяется именно незаполненностью электронной оболочки.
Кислород - не менее замечательный элемент, так как он не досчитывает двух периферических электронов для заполнения своей второй электронной оболочки: его первая оболочка содержит два электрона, а вторая вместо восьми всего шесть. Чтобы она была устойчива, ему нужно еще два электрона. Отсюда у кислорода резко выраженный электроположительный характер, он атакует все атомы, отдающие электроны, и поэтому оказывается одним из наиболее активных элементов в природе.
Греческий философ Фалес из Милета рассматривал воду как основу всего земного. До конца XVIII в. никто не высказывал сомнения, что вода - единое неделимое вещество. Только в 1781 г. Генри Кавендиш в Англии доказал, что вода состоит из двух элементов, а Антуан Лавуазье во Франции назвал эти два элемента кислородом и водородом, т. е. рождающим воду.
Охотно соединяясь, иногда даже со взрывом (известный гремучий газ - это два объема водорода и один кислорода), водород и кислород при соединении обеспечивают создание устойчивой молекулы, в которой электроны "находят себя", так как оба элемента живут как бы при дефиците электронов. Атомы и электроны особым образом располагаются в микропространстве, их внешние (у кислорода) электроны объединяются. В результате молекуле воды оказывается свойственна дисимметрия: кислородная часть молекулы имеет отрицательный заряд, а водородная - положительный. Они смещены относительно друг друга, поэтому такая молекула похожа на маленький электромагнит. Когда молекулу воды пытаются нарисовать (хотя строение молекулы Н2О еще до конца не выяснено), то она оказывается похожей на Чебурашку, уши которого - это два атома водорода, а тело - атом кислорода. Более реальная, но и более абстрактная пространственная схема - это представление о молекуле воды, как о тетраэдре или четырехлопастном винте с двумя положительными и двумя отрицательными зарядами на вершинах тетраэдра или концах лопастей винта. В центре таких фигур будет находиться ядро атома кислорода, на двух соседних вершинах или лопастях - положительно заряженные атомы водорода, а на двух других - отрицательно заряженные электроны.
 Схематические варианты строения молекулы воды.
Схематические варианты строения молекулы воды. Молекулы воды оказываются чрезвычайно устойчивыми, поскольку атомы кислорода и водорода связаны друг с другом посредством образования электронных пар. Это так называемая ковалентная связь. Такую молекулу очень трудно разрушить, поэтому вода способна существовать в условиях разнообразных и очень сильных воздействий, например, в космосе и в мантии Земли.
Сконструированные наподобие магнитов молекулы воды и взаимодействуют как настоящие магниты, создавая пространственные структуры, так как каждая вершина тетраэдра или лопасти может притянуть по одной молекуле воды, а всего - четыре молекулы. Электрические взаимодействия между водородом одной молекулы и сравнительно свободными парами электронов другой образуют так называемую водородную связь. Такие связи и возникающие пространственные структуры молекул определяют межмолекулярную структуру воды, которая служит одной из причин ее уникальности.
Межмолекулярной структурой воды занимались многие выдающиеся ученые: Дж. Бернал, Л. Полинг, Р. Хорн и другие. Выдвинуто множество гипотез, число которых продолжает расти. Но простая формула Н2О - вещества, считающегося наиболее исследованным на Земле, - скрывает чрезвычайно сложную систему, о которой американский геохимик Р. Хорн писал: "Невозможность определить структуру воды с помощью эффективных современных методов исследований, позволивших разобраться в структуре таких чрезвычайно сложных биомолекул, как ДНК и миоглобин, должным образом предупреждает нас о том, что мы имеем дело с необычайно сложной системой". Американский журнал "Science" в 1969 г. писал: "Никакая модель не может объяснить все свойства воды". В то же время фундаментально различные модели воды часто одинаково хорошо описывают ее термодинамические свойства.
То, что обычная вода представляет собой еще весьма плохо изученное вещество, объясняется не только сложностью и неопределенностью ее структуры, но и тем, что это жидкое вещество. Значительно легче, нежели жидкое, исследовать твердое вещество или газ, так как в первом молекулы четко упорядочены, а во втором - они слабо взаимодействуют и обладают большой свободой передвижения. Ответа на вопрос: почему существуют две формы конденсированного из газа состояния вещества - жидкое и твердое, - близкие по плотности и энергии межмолекулярного взаимодействия и колоссально отличающиеся по кинетике межмолекулярного взаимодействия, пока еще нет. Не создано теорий, которые адекватно описывали бы жидкое состояние. Не разработана также теория плавления - перехода от порядка к беспорядку в системах с близкими плотностями и энергиями межмолекулярного взаимодействия. Поэтому, например, лед изучен лучше, чем вода.
Попытки выявления структуры воды не прекращаются и по сей день. Одну из самых плодотворных идей на этот счет высказал в середине нашего века советский ученый О. Я. Самойлов. Он предположил, что во льду все молекулы воды связаны между собой и образуют ажурную решетку. В этой решетке расстояния между атомами кислорода больше размера одиночной молекулы, т. е. она пронизана "дырами" или "пустотами". При таянии и последующем повышении температуры такая "льдистая" структура постепенно разрушается и, наряду с частично сохранившимся каркасом, появляются неупорядоченные молекулы воды, которые могут заполнять "дыры". Гипотеза О. А. Самойлова хорошо объясняет аномалию льда - его меньшую плотность по сравнению с жидкой водой, а потому способность в ней плавать. Между тем другие жидкости при затвердевании образуют вещество всегда большей плотности, чем плотность первоначальной жидкости, и тонущее в ней. Вода, уменьшаясь в объеме при охлаждении и увеличивая при этом плотность, ведет себя как все прочие жидкости, но, достигнув наибольшей плотности при температуре 4 °С, при дальнейшем ее понижении начинает расширяться и особенно сильно (почти на 11%) увеличивает свой объем при превращении в лед. По предлагаемой О. Я. Самойловым гипотезе при падении температуры ниже 4 °С что-то заставляет одиночные молекулы "вылезать" из своих "нор" и становиться кирпичиками упорядоченной льдистой структуры, наращивая объем и уменьшая плотность льда. Не очень ясно, что заставляет вылезать их из межатомных нор. Например, давно известно, что чистая вода "не любит" замерзать. В лабораториях дистиллированную воду удавалось охлаждать до 70 °С ниже нуля, и она не замерзала. Но стоило в такую воду бросить кристаллик льда, песчинку или ввести пузырек воздуха, как происходило мгновенное замерзание и повышение температуры воды до О °С. Включения, заставляющие замерзать переохлажденную воду, называют центрами кристаллизации. Неясно только, почему центрами кристаллизации не могут быть сами льдистые структуры.
Советский океанолог Н. Н. Зубов вспоминал случай из своей молодости, когда в начале зимы, но уже при достаточно ощутимом морозе он на телеге доехал до небольшого неглубокого озёра, через которое надо было перебраться. Как только лошадь ступила в воду, вокруг ее ног начал образовываться ледок и буквально на глазах все озерко быстро покрылось льдом. Вода в озерке была очень чистая, а дни стояли тихие, безветренные.
Сейчас выяснено, что замерзание переохлажденной воды происходит и при воздействии ультразвуковых колебаний. Почему - также неясно.
Если бы вода не обладала способностью уменьшать свою плотность при затвердевании (льдообразовании) за счет увеличения объема, то формирующийся в водоемах лед осел бы на дно и вся гидросфера очень быстро могла бы превратиться в огромную глыбу льда. Это привело бы к необратимым изменениям на Земле, которая, полностью обледенев, уже не смогла бы выйти из этого состояния. Характер изменения плотности воды создает условия для расслоения (стратификации) воды по плотности подо льдом таким образом, что зимой в пресных водоемах с глубиной вода становится теплее. Ее температура от нижней поверхности льда до дна повышается от О °С до 4 °С, т. е. температуры наибольшей плотности.
Способность чистой воды к переохлаждению приводит к таким явлениям на пресноводных водоемах, как образование внутриводного льда, который нередко забивает решетки водоприемных устройств в зимний период.
Гипотеза льдистой структуры предполагает, что она разрушается не сразу после таяния, а сохраняется в виде фрагментов очень долго, вплоть до температуры кипения, даже водяной пар при преобладании одиночных молекул содержит сростки молекул воды в количестве до 10%. Но если это так и жесткая льдистая структура сохраняется в жидкой воде, и на первых этапах, особенно сразу после таяния, вода остается сильно структурированной, то тогда почему она жидкая и течет? Чтобы как-то объяснить это, выдвигают разные гипотезы, строят другие модели структуризации молекул воды. Например, предполагается существование двух-, четырех- и восьмичленных структур, при этом каждой температуре соответствует свой набор таких ассоциаций и просто одиночных молекул. Двух- и четырехчленные ассоциации представлены цепочками, а восьмичленные имеют форму замкнутых треугольных призм. Высказано также предположение о кластерной структуре воды, т. е. существовании связных "сгустков", в которые соединены по 12-150 молекул со свободным пространством между ними. Такие сгустки быстро создаются и быстро распадаются, и поэтому их называют "мерцающими" кластерами. В последнее время выдвигается мнение о недооценке в большинстве моделей воды структуры самой молекулы Н2О и возможной динамики ее изменения в процессе молекулярного взаимодействия. Эта молекула уникальна: она представляет собой так называемый двойной симметричный донор и акцептор протонов, т. е. одинаково охотно отдает и забирает протоны, причем переходы протонов осуществляются как в самой молекуле, так и между молекулами в зависимости от давления и температуры в больших объемах. Поэтому водородные связи в воде определяют межмолекулярные взаимодействия и ее свойства.
Подобные гипотезы позволяют воде быть структурированной и в то же время жидкой и текучей и пытаются объяснить такое свойство, отличающее ее от других жидкостей, как уменьшение вязкости при увеличении давления (у других жидкостей все происходит "нормально" - с увеличением давления вязкость растет). Такое уникальное свойство воды обеспечивает ее большую подвижность глубоко в недрах планеты, где давление достигает огромных значений.
На поверхности Земли при существующих условиях вода стремится остаться преимущественно в жидком состоянии. Чтобы перевести ее из жидкого состояния в парообразное или из твердого в жидкое, надо затратить большое количество энергии, которое требуется, как это следует из гипотез, для разрушения ее межмолекулярной структуры. Обычно такие затраты энергии называют скрытой теплотой испарения или таяния). Чтобы превратить лед в воду, надо затратить 332,43 Дж на 1 г, а для превращения такого же количества воды в пар требуется 2258,5 Дж. При обратных переходах - превращении пара в воду и воды в лед - из каждого грамма воды выделяется эквивалентное количество тепла.
При испарении воды разрываются все межмолекулярные связи. Превращение льда в воду (таяние) требует много меньше затрат энергии, чем испарение, что может свидетельствовать о разрыве только части межмолекулярных связей - не более 20% (судя по соотношению цифр, 332 и 2258) - при ее переходе из твердого в жидкое состояние. Следовательно, в талой воде с температурой около О °С в основном сохраняется льдоподобная структура, но даже сравнительно небольших ее нарушений оказывается достаточно для перехода воды из твердого в жидкое состояние. Скрытая теплота плавления воды - наиболее высокая среди всех веществ за исключением аммиака и водорода, а скрытая теплота испарения - наиболее высокая из всех веществ, т. е. и по этим свойствам вода выступает как уникальная субстанция. Итак, чтобы испарить воду, надо затратить огромное количество тепла. Уже известно, что основная часть солнечной энергии, поглощаемая гидросферой, затрачивается на испарение.
 Рис. 5.3. Скрытая теплота плавления и испарения воды. В точке плавления 1 г воды поглощает 333,7 Дж (79,7 кал) без повышения температуры, а в точке испарения 2258,5 Дж (539,4 кал), также без повышения температуры.
Рис. 5.3. Скрытая теплота плавления и испарения воды. В точке плавления 1 г воды поглощает 333,7 Дж (79,7 кал) без повышения температуры, а в точке испарения 2258,5 Дж (539,4 кал), также без повышения температуры. Каждую минуту на испарение с поверхности океана уходит 2*1018 Дж солнечной энергии. Но это тепло не потеряно для планеты. При конденсации пара в верхней части тропосферы тепло, затраченное на испарение, вновь выделяется. Водяной пар выступает как теплоноситель, перемещающий тепло Солнца, для излучения которого атмосфера прозрачна, от поверхности океана и увлажненной поверхности суши к уровню конденсации в атмосфере. Мощные импульсы тепла, возникающие при конденсации, служат одним из двигателей циркуляции атмосферы и, возможно, источниками энергии тропических ураганов. Пары воды в атмосфере играют и другую, не менее важную роль: они перехватывают и поглощают тепловое (инфракрасное) излучение Земли, создавая парниковый эффект. Роль водяного пара в парниковом эффекте, как уже говорилось, значительно существеннее, чем роль углекислого газа. Атмосферную влагу можно сравнить с теплым одеялом, окутывающим нашу Землю.
Весну и осень умеренных широт можно рассматривать как время перестройки структуры воды в первом случае от льдистой к квазильдистой и во втором - наоборот. Для подобной перестройки весной необходимо много тепла и времени, так как приток тепла нарастает сравнительно медленно, а запасы снега на поверхности земли бывают велики. Осенью, наоборот, выделяющаяся скрытая теплота замерзания тормозит процесс установления зимы. Потому и существуют эти сезоны в умеренных широтах. Наглядное представление о выделяемых количествах тепла дает такое сравнение - 1 м3 воды при замерзании выделяет примерно столько же тепла, сколько его получается при сжигании 10 кг угля. В течение весеннего и осеннего сезонов за счет скрытой теплоты плавления (замерзания) происходит обмен таким количеством тепла, которое эквивалентно 2*1011 т сожженного угля, что намного превышает годовую добычу его во всем мире.
Чтобы изменить температуру воды на 1 °С, нужно затратить (добавить при нагревании) 4,19 Дж тепла. Эта величина называется удельной теплоемкостью. У воды она одна из самых высоких, значительно больше, чем у любого другого вещества, за исключением жидкого аммиака и водорода, и примерно в 10 раз больше, чем у пород, слагающих земную кору.
Тепловые характеристики воды имеют огромное значение для климата Земли, в системе которого вода выступает хранителем и переносчиком тепла, а также тепловым тормозом и стабилизатором. Гидросфера гасит теплые и холодные импульсы через изменение интенсивности испарения или путем смены соотношения между массами таких своих составляющих, как твердая (ледники) и жидкая (в основном океан). Вода через океаническую составляющую гидросферы уменьшает различия в температуре между низкими (экваториальными) и высокими (полярными) широтами, так как мощные течения несут к полюсам огромные массы нагретой в тропиках воды, а от полюсов - холодные воды к тропикам. Теплые и холодные океанические течения настолько сильно воздействуют на омываемые ими участки континентов, что существенно меняют широтную географическую зональность. Наконец, вода на суше уменьшает разницу между дневными и ночными температурами, когда при образовании росы, изморози или тумана в приземном слое воздуха выделяется скрытая теплота.
За счет огромной теплоемкости воды морские течения и крупные реки долго сохраняют свои свойства, изменяя прилегающие к ним участки. Например, течение Гольфстрим делает Мурманск незамерзающим портом, тогда как Архангельск, расположенный на 500 км южнее, надолго закрывается в период ледостава. Сибирские реки, текущие с юга на север, отепляют прилегающие к ним территории, по их долинам тайга вклинивается далеко в тундру. Разница в теплоемкости океана и суши создает системы бри зовых и муссонных ветров. Наконец, увлажнение поверхности суши после осадков резко меняет физические свойства этой поверхности.
Молекулы, находящиеся внутри массы воды, испытывают притяжение соседних молекул-магнитиков во всех направлениях. Если же молекула расположена на поверхности, то такое притяжение возможно только в нижней полусфере вокруг молекулы. Она как бы втягивается внутрь водной массы. Этим самым создается пленка поверхностного натяжения. Поверхностное натяжение воды больше, чем у любой другой жидкости за исключением ртути, но внесение даже минимального количества разных добавок к воде резко уменьшает ее поверхностное натяжение. Предполагается, что у абсолютно чистой воды поверхностное натяжение таково, что по поверхности такой воды можно кататься на коньках. Есть насекомые, которые используют поверхностное натяжение для передвижения по акваториям. Может быть, библейская легенда о "хождении по водам" отражает когда-то существовавшее умение с помощью каких-то добавок приближать поверхностное натяжение воды к идеальному?
В естественной воде много разнообразных включений, которые обычно снижают поверхностное натяжение, и поэтому оно не препятствует возникновению волн и ряби даже при небольшом ветре. Волнение и рябь увеличивают площадь водной поверхности, так как она сморщивается. Для океана, например, это увеличение может достигать 50% - гигантской величины. А увеличение поверхности означает и рост испарения.
Вода обладает высокой способностью смачивать твердые тела, т. е. прилипать к ним при соприкосновении. При смачивании тонким слоем за счет поверхностного натяжения она может прочно удерживаться на поверхности твердых частиц. Смачивание и поверхностное натяжение позволяют воде передвигаться по тонким порам и трещинам вопреки силе тяжести, так как на границе со смоченной породой край водной поверхности за счет смачивания и прилипания ползет вверх, образуя в малой поре, канале или трещине вогнутую поверхность. А вогнутую поверхность натяжение стремится выровнять, за счет этого и происходит движение воды. Эта способность создает в почве и верхних слоях подпочвенного грунта так называемую подвешенную воду, которая, удерживаясь поверхностным натяжением, не стекает в более глубокие горизонты, обеспечивая растения влагой. Поверхностное натяжение и смачивание позволяет воде вопреки силе тяжести подниматься по тонким порам-капиллярам на 10-12 м.
Замечательным и важным свойством воды надо считать ее способность растворять разнообразные вещества. Это самый сильный природный растворитель: в воде растворяются в той или иной мере почти все вещества. Сильный разнос центров положительных и отрицательных зарядов в молекуле воды приводит к тому, что молекулы ориентируются в электрическом поле, стремясь нейтрализовать его. Иными словами, обладают высоким дипольным моментом, что обеспечивает уникально большую диэлектрическую постоянную воды, наиболее высокую среди всех жидкостей. В результате любые заряды в воде отталкиваются или притягиваются с силой, в 80 раз большей, чем в вакууме. Это обеспечивает высокую растворимость веществ в воде, так как молекулы воды "растаскивают" частицы или ионы веществ, сила притяжения между которыми ослаблена. Это же обеспечивает прилипание и высокую способность к смачиванию.
Все элементы таблицы Менделеева в том или ином количестве можно обнаружить в водах гидросферы. Растворенные вещества тоже влияют на структуру воды, а следовательно, на ее свойства. Сам процесс растворения нередко сопровождается выделением тепла, при этом чем лучше вещество растворяется, тем больше выделяется тепла. Однако с водой бывают всякие неожиданности. Так, например, плохо растворяющийся в воде метан при растворении отбирает из воды слишком много тепла, температура воды падает, а на границе раздела крупной молекулы метана и небольшой молекулы воды, где происходят наибольшие потери тепла, вода может принять льдистую структуру, т. е. замерзнуть.
В телах растений вода соседствует с белком, молекулы которого обычно намного больше молекул воды. Такие молекулы ведут себя подобно молекулам метана, расталкивая молекулы воды, разрывая их связи и создавая вокруг себя оболочку из водных молекул. При разрывах связей вода теряет тепло, а на границе белковой и водной молекул возникает тенденция к кристаллизации воды. Это явление вызывает повреждение растений при температуре значительно выше 0 °С. При растворении происходят и другие интересные процессы. Если в дистиллированной воде растворить обычную поваренную соль (NaCl) с таким расчетом, чтобы получился 1 кг морской воды, то понижение температуры воды бу дет соответствовать потере примерно 2514 Дж. Кроме того, объем раствора окажется меньше суммы первоначальных объемов воды и соли. Раствор как бы сожмется. Это явление называется электрострикцией. Каждый ион в растворе обволакивают молекулы воды - гидратируют его. Уплотнение достигает нескольких десятых процента от объема. Поэтому, например, когда смешиваются две естественные массы воды разной солености и температуры, но одинаковой плотности, происходит уплотнение смешанного раствора. Это явление имеет существенное значение для динамики гидросферы.
Таким образом, одни ионы и частицы уплотняют воду, а другие могут делать ее более рыхлой. Одни ионы приближают ее к структуре льда, а другие могут удалять от нее. В примере с поваренной солью уплотнение соответствовало давлению в 100 атм. К разуплотняющим воду веществам, которые снижают давление внутри нее, относятся ионы калия, рубидия, цезия, брома, йода. Может быть, некоторые морские животные, умеющие погружаться на большие глубины, обладают способностью выделять вещества, разуплотняющие воду и снижающие давление? Вопрос этот пока лежит в сфере научной фантастики. Вода - это инертный растворитель, который обычно не вступает в реакцию с растворенным веществом. Это свойство исключительно важно для жизни, так как в живых системах вода служит инертным носителем разнообразных жизненно важных веществ.
На Земле нет абсолютно чистой воды, и получить ее не так просто. Даже так называемая дистиллированная вода, которую покупают в аптеках, содержит небольшие дозы растворенных веществ из стенок стеклянных бутылок, в которых она хранится. Каждый раз, выпивая стакан горячего чая, мы вместе с ним выпиваем примерно 0,0001 г растворенного стекла (обычно силикат натрия). Легко подсчитать, что в течение жизни вместе с чаем в наш организм поступает 0,1 г стекла. Чтобы полностью растворить стакан при чаепитии, понадобится много поколений людей. Вероятность разбить стакан за этот период неизмеримо выше.
Природные растворы в одних случаях бывают насыщенными и даже перенасыщенными, а в других случаях - слабыми; иногда они равновесные, а иногда - неравновесные. Чем быстрее жидкая вода движется по поверхности суши, тем дальше она от насыщения растворенными веществами. Но большая часть гидросферы малоподвижна, а потому она соленая и близка к равновесию.
Растворенные в воде вещества, изменяя ее структуру, меняют и свойства. Так, электропроводность растворов обычно возрастает в десятки тысяч раз, что объясняется появлением в воде большого количества ионов, переносящих электрические заряды. Падает температура замерзания воды. Например, морская вода замерзает при температуре -1,9 °С, но лед из морской воды образуется пресный, хотя первоначально возникающий лед содержит в себе карманы с соленой водой. Рассол из таких карманов постепенно стекает, и старый морской лед обычно пресен. В прошлом веке это даже породило уверенность, что морская вода не замерзает. Считалось, что ледяной покров Северного Ледовитого океана - это скопление вынесенного реками речного льда. Такой точки зрения придерживался и М. В. Ломоносов. В то время еще не был открыт Антарктический материк и мореплаватели, наблюдая за гигантскими айсбергами, строили предположения о грандиозных реках на южнополярном материке, выносящих такие гигантские льдины. Сейчас это свойство самовымораживания солей из сильно минерализованной воды используется в засушливых и в то же время холодных районах для получения пресной воды из соленых подземных вод. Рассолы некоторых озер замерзают при -21 °С, а вот в Антарктиде в иные годы - и при -50 °С, что обусловлено высокой минерализацией и хлоридно-кальциевым составом воды здешних озер.
Температура замерзания воды понижается и при повышении давления, что, как сказано выше, как бы соответствует растворению в ней солей. Так, на ложе Антарктического ледника температура ее замерзания -2,4 °С. Если все время наращивать давление до очень больших величин, то образующийся в таких условиях лед становится тяжелым и тонет в воде. При дальнейшем повышении давления он снова становится легче воды, но температура его плавления повышается до 80 °С. Существуют и такие модификации льда высокого давления, которые плавятся при температуре 175 °С, т. е. лед может стать горячим. Если в воду попадают тонкодисперсные частицы, не растворяющиеся в ней, то молекулы воды, вступая в контакт с адсорбирующей поверхностью, теряют свою подвижность, связываются с этой поверхностью, выделяя при этом внутреннюю кинетическую энергию, которую называют теплотой смачивания. Количество энергии зависит от размеров и минерального состава частиц. По оценкам, при выпадении на поверхность воды 1 г тонкоразмолотых частиц некоторых минералов выделяется до 3352 Дж тепла. В океанах есть зоны, где выпадение мельчайших частиц отмечается как сравнительно постоянное явление. Наиболее интенсивно оно идет в Атлантическом океане к западу от берегов Африки, где над океаном протягивается шлейф эоловых частиц из Сахары - пылевые туманы. Глобальная масса минеральных эоловых частиц, ежегодно поступающая в океан, оценивается в (2,2-6,6)*1015 г. Это может дать (0,75-21,8)*1019 Дж дополнительного тепла, что примерно в 10 раз больше солнечного тепла, затрачиваемого ежесуточно на испарение воды со всей поверхности Мирового океана. Техногенные пылевые выбросы дают в 10 раз меньше естественных выбросов. Учитывая то, что как раз в Атлантике, у западного побережья Африки, зарождаются тропические ураганы и именно там находится крупнейшая область поступления тонкодисперсных эоловых частиц, можно поставить вопрос: не вносит ли выделяющаяся теплота смачивания свой вклад в формирование этих ураганов? Может быть, стоит сопоставить частоту пылевых туманов с частотой возникновения ураганов? Физические свойства воды резко меняются и тогда, когда она попадает в дисперсные среды, например в микропоры глины, оказывается физически связанной или рассредоточена в очень малых объемах. Очень сильно меняются ее подвижность, плотность, температура замерзания, поверхностное натяжение и многие другие свойства. Уникальные свойства воды становятся аномальными - не правда ли, это звучит как парадокс?
Несмотря на уникальность свойств, а может быть, и благодаря им, а также в связи с устойчивостью и распространенностью на Земле вода была выбрана в качестве вещества, некоторые физические характеристики которого стали единицами измерений температуры, тепла и массы. Температуру замерзания воды в условиях нормального атмосферного давления приняли за нуль, а температуру кипения - за 100° в широко принятой шкале Цельсия. Количество тепла, необходимого для нагревания 1 г воды от 15 до 16 °С, назвали калорией и использовали эту единицу для измерения количества тепла. Масса 1 см3 дистиллированной воды при температуре ее наибольшей плотности названа граммом и используется для определения массы.
Та вода, с которой каждый человек встречается ежедневно, на самом деле мало похожа на идеально чистую воду, а последняя попросту не должна существовать, так как она никак не укладывается в предписанные ей природой законы, нисколько не считаясь со свойствами соединений того же ряда. Но мы должны быть благодарны этому простому и в то же время очень сложному веществу за то, что оно далеко от идеала, иначе жизнь была бы невозможна и вообще неясно - смогла ли бы в идеальной воде возникнуть жизнь. Например, если бы поверхностное натяжение воды на нашей планете соответствовало таковому идеально чистой воды, то вряд ли смог бы существовать круговорот воды.
abratsev.ru
Физические свойства воды - Знаешь как
Оглавление 70 71 72 73 74 — — — 270
Физические свойства воды. Чистая вода представляет собой бесцветную прозрачную жидкость, не имеющую ни запаха, ни вкуса. Вес 1 мл чистой воды при 4° принимается за единицу веса и называется граммом.
В отличие от большинства других веществ, плотность которых при охлаждении непрерывно увеличивается, вода обладает при 4° наибольшей плотностью. Как выше, так и ниже этой температуры плотность воды меньше. Указанная аномалия воды имеет очень большое значение. Благодаря ей глубокие водоемы не промерзают зимой до дна и в них сохраняется жизнь.
Не меньшее значение в жизни природы имеет и другая аномалия воды — из всех твердых и жидких веществ вода имеет наибольшую теплоемкость. Поэтому в зимнее время она медленно остывает, а летом медленно нагревается, являясь, таким образом,, регулятором температуры на земном шаре.
Температура замерзания чистой воды принимается за начальную точку стоградусной термометрической шкалы и обозначается цифрой 0, температура кипения воды при нормальном давлении отмечается на шкале цифрой 100.
Весовой состав воды выражается следующими числами: 11,11% водорода и 88,89% кислорода. Отсюда простейшая формула воды будет Н2О. Определение молекулярного веса воды по плотности ее пара при высоких температурах дает величину, равную 18, что отвечает простейшей формуле. Однако с приближением к точке кипения воды плотность пара слегка увеличивается и молекулярный вес получается несколько больше 18. Молекулярный вес жидкой воды, определяемый, путем растворения ее в подходящих растворителях , тоже оказывается более высоким, чем можно было бы ожидать на основании простейшей формулы. Все эти факты привели к заключению, что жидкая вода наряду с простыми молекулами Н2О и в равновесии с ними содержит более сложные молекулы, состав которых выражается общей формулой (Н2О)х. Такое соединение простых молекул в более сложные, не вызывающее изменения химической природы вещества, носит название ассоциации молекул.
Ассоциация молекул обусловливается, вообще говоря, их полярностью, благодаря которой молекулы притягиваются друг к другу своими разноименными полюсами, образуя удвоенные, утроенные и так далее молекулы (рис. 60). Но для воды основной причиной ассоциации является образование так называемых «водородных» связей между молекулами.
Исследованиями установлено, что атом водорода, ковалентно связанный с атомом сильно электроотрицательного элемента (особенно фтора или кислорода), может вступать в связь еще с другим атомом такого же элемента. Эта вторая связь и называется водородной связью.

Рис. 60. Ассоциация полярных молекул.
Такая особенность водородного атома обусловливается тем, что, отдавая свой единственный электрон на образование связи с сильно электроотрицательным элементом, он остается в виде ядра очень малого размера, почти лишенного электронной оболочки. Поэтому он не испытывает отталкивания от электронной оболочки другого атома, а наоборот, притягивается ею и может вступать с ней во взаимодействие.
В жидкой воде водородная связь образуется между атомом водорода одной молекулы воды и атомом кислорода другой молекулы воды согласно схеме

в которой водородные связи отмечены точками. Таким же путем образуются в воде и более сложные молекулярные агрегаты.
Наибольшей устойчивостью обладают удвоенные молекулы (Н20)г, образование которых, повидимому, сопровождается возникновением двух водородных связей:

Ассоциацией молекул воды могут быть объяснены и те аномалии в ее свойствах, о которых мы говорили выше. Предполагают, что при 0° вода в значительной мере состоит из молекул (Н2О)3. При нагревании от 0° до 4° утроенные молекулы диссоциируют с образованием молекул (Н2О)2, которые сообщают
воде большую плотность, вероятно вследствие наличия в них двух водородных связей. Дальнейшее нагревание ведет к распаду двойных молекул на простые, и плотность воды постепенно уменьшается. Но даже при 100° вода и водяной пар еще содержат некоторое количество двойных молекул, вследствие чего плотность водяного пара при 100° не вполне отвечает простейшей формуле воды Н2О.
Большая теплоемкость воды также может быть объяснена диссоциацией сложных молекул при нагревании. Так как процесс диссоциации сопровождается поглощением тепла, то при нагревании воды тепло расходуется не только на повышение температуры, но и на разложение ассоциированных молекул. В о д я н о й п а р. Как и всякая жидкость, находящаяся в открытом сосуде, вода более или менее быстро испаряется. Если же поместить жидкость в замкнутое пространство, пустое или уже занятое каким-либо газом, то она будет испаряться лишь до тех пор, пока между нею и образующимся из нее паром не установится динамическое равновесие, при котором в единицу времени столько же молекул испаряется, сколько и переходит обратно в жидкость. Пар, находящийся в равновесии с жидкостью, из которой он образовался, называется насыщенным. Давление его при данной температуре у различных жидкостей различно. Например, при 20° давление насыщенного пара воды равно 17,4 мм, спирта — 43,9 мм, эфира — 442 мм и т. д. Испарение — эндотермический процесс. Поэтому повышение температуры в соответствии с принципом Ле-Шателье смещает равновесие между жидкостью и ее паром в сторону парообразования и давление пара увеличивается.
Давление водяного пара при различных температурах выражается следующими цифрами:
Температура в °С . . . 0 20 40 60 80 100
Давление в мм рт. ст. 4,6 17,4 55,0 149,2 355,5 760
Когда давление пара какой-либо жидкости достигает величины внешнего давления, жидкость закипает. Температура кипения воды при нормальном атмосферном давлении равна 100°, потому что при этой температуре давление водяного пара равно 760 мм.Превращение воды в пар сопровождается поглощением большого количества тепла. Так, чтобы превратить 1 моль воды, имеющей температуру 100°, в пар при той же температуре, надо затратить 9,7 ккал. При обратном превращении, пара в воду это же количество тепла выделяется.
Лед. Если отнимать тепло от воды, имеющей температуру 0° и находящейся под обыкновенным давлением, то вода переходит в твердое состояние — лед. Наоборот, если нагревать лед, имеющий температуру 0°, то он тает, превращаясь в воду. Смесь воды и льда остается при 0° без изменения, если она не получает тепла и не отдает его во внешнее пространство.
На этом основании температуру замерзания или, что то же, температуру плавления можно определить как такую температуру, при которой жидкость находится в равновесии с твердой фазой того же вещества.
Выделение тепла при замерзании воды (равно как и поглощение тепла при таянии льда) составляет 1,42 ккал на каждый моль воды.
Переход воды в лед сопровождается значительным увеличением объема, вследствие чего удельный вес льда равен только 0,92, т. е. лед легче воды. С увеличением давления точка перехода воды в лед сперва понижается (например, под давлением 615 ат вода замерзает только при —5°), но затем (после 2000 ат) начинает повышаться и при очень больших давлениях становится выше 0°.
Исследования показали, что под давлением выше 2000 ат, кроме обыкновенного льда, могут существовать еще пять различных форм льда с удельным весом выше единицы, которые обозначаются римскими цифрами II, III, IV, V и VI. Для льда VI, образующегося под давлением 20 760 ат, предложено название «горячий лед», так как он плавится при +76°.
Лед, как и вода, может испаряться. В замкнутом пространстве испарение льда продолжается до тех пор, пока давление образующегося из него пара не достигнет некоторой определенной для данной температуры величины. Давление пара льда при 0° такое же, как и давление водяного пара при 0°, т. е. равно 4,6 мм. С понижением температуры давление пара льда быстро уменьшается: при минус 20° оно равняется только 0,8 мм, а при минус 50° составляет всего 0,3 мм. Поэтому испарение льда идет гораздо медленнее, чем испарение воды.
Показанная выше зависимость между давлениием водяного пара и температурой, а также условия одновременного существования воды в различных фазах могут быть наглядно представлены при помощи так называемой диаграммы состояния воды (рис. 61).
На этой диаграмме линия OA представляет кривую давления паров воды, а линия ОВ — кривую давления паров льда. Точки кривой OA показывают, при каких температурах и давлениях могут одновременно существовать в равновесии вода и пар; точки кривой ОВ определяют условия равновесия между льдом и паром. Обе кривые пересекаются в точке О,указывающей температуру и давление, при которых могут находиться в равновесии все три фазы. Поэтому точка О называется тройной точкой; ей отвечает давление 4,6 мм и температура +0,007°. Кривая ОС показывает влияние давления на точку плавления льда. Каждой ее точке соответствует определенное давление и определенная температура, при которых лед и вода находятся в равновесии. Кривые OA, ОВ и ОС делят всю площадь диаграммы на три области, из которых каждая соответствует устойчивости только одного из трех агрегатных состояний воды. При температурах и давлениях, отвечающих точкам, лежащим в области АОС,. вода может существовать только в жидком состоянии. Точно так. же точки областей, отмеченных на диаграмме словами «лед» и «пар», определяют те температуры и давления, при которых возможно существование только твердой или только газообразной фазы.
71 72 73
Вы читаете, статья на тему Физические свойства воды
znaesh-kak.com