Влияние концентрации технического этиленгликоля в воде на плотность и температуру замерзания смеси. Этиленгликоль вода
Этиленгликоль — Вода. Плотность, температура замерзания, теплоемкость Cp, теплопроводность, водного раствора этиленгликоля = monoethylenglycol — основного антифриза и теплоносителя для систем отоплен
Этиленгликоль — Вода. Плотность, температура замерзания, теплоемкость Cp, теплопроводность, водного раствора этиленгликоля = monoethylenglycol = MEG= C2h5(OH)2 — основного антифриза=теплоносителя для систем отопления / центрального кондиционирования в РФ.
| Объемная доля в смеси % | Минимальная рабочая температура ( замерзания), °C | Температурараствора °C | Плотностьrкг/м3 | Теплоемкость CpкДж/(кг*К) | ТеплопроводностьВт/(м*К) | Динамическая вязкость 10-3 (Н*с/м2) | Кинематическая вязкость 10-6(м2/с)=мм2/с=cSt |
| 20 | -10 | -10 | 1038 | 3,85 | 0,498 | 5,19 | 5,0 |
| 0 | 1036 | 3,87 | 0,500 | 3,11 | 3,0 | ||
| 20 | 1030 | 3,90 | 0,512 | 1,65 | 1,6 | ||
| 40 | 1022 | 3,93 | 0,521 | 1,02 | 1,0 | ||
| 60 | 1014 | 3,96 | 0,531 | 0,71 | 0,7 | ||
| 80 | 1006 | 3,99 | 0,540 | 0,523 | 0,52 | ||
| 100 | 997 | 4,02 | 0,550 | 0,409 | 0,41 | ||
| 34 | -20 | -20 | 1069 | 3,51 | 0,462 | 11,76 | 11,0 |
| 0 | 1063 | 3,56 | 0,466 | 4,89 | 4,6 | ||
| 20 | 1055 | 3,62 | 0,470 | 2,32 | 2,2 | ||
| 40 | 1044 | 3,68 | 0,473 | 1,57 | 1,5 | ||
| 60 | 1033 | 3,73 | 0,475 | 1,01 | 0,98 | ||
| 80 | 1022 | 3,78 | 0,478 | 0,695 | 0,68 | ||
| 100 | 1010 | 3,84 | 0,480 | 0,515 | 0,51 | ||
| 52 | -40 | -40 | 1108 | 3,04 | 0,416 | 110,8 | 100 |
| -20 | 1100 | 3,11 | 0,409 | 27,50 | 25 | ||
| 0 | 1092 | 3,19 | 0,405 | 10,37 | 9,5 | ||
| 20 | 1082 | 3,26 | 0,402 | 4,87 | 4,5 | ||
| 40 | 1069 | 3,34 | 0,398 | 2,57 | 2,4 | ||
| 60 | 1057 | 3,41 | 0,394 | 1,59 | 1,5 | ||
| 80 | 1045 | 3,49 | 0,390 | 1,05 | 1,0 | ||
| 100 | 1032 | 3,56 | 0,385 | 0,722 | 0,7 |
Похожие статьи
e4-cem.ru
Этиленгликоль - это... Что такое Этиленгликоль?
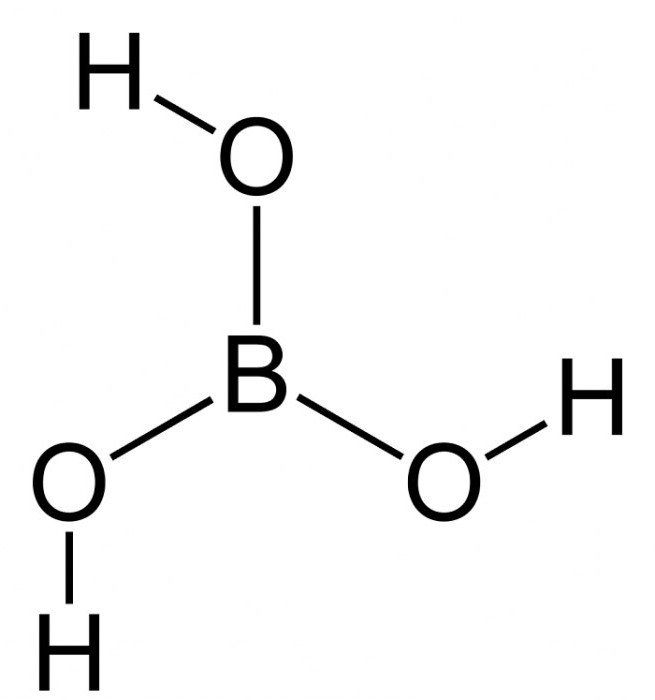
Этиленглико́ль (гликоль; 1,2-диоксиэтан; этандиол-1,2), HO—Ch3—Ch3—OH — простейший представитель полиолов (многоатомных спиртов).
В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Токсичен. Попадание этиленгликоля или его растворов в организм человека может привести к необратимым изменениям в организме и к летальному исходу[1].История открытий и производства
Этиленгликоль впервые был получен в 1859 французским химиком Вюрцом из диацетата этиленгликоля омылением гидроксидом калия и в 1860 гидратацией этиленоксида. Он не находил широкого применения до Первой мировой войны, когда в Германии его стали получать из дихлорэтана для использования в качестве замены глицерина при производстве взрывчатых веществ. В США полупромышленное производство начато в 1917 году через этиленхлоргидрин. Первое крупномасштабное производство начато с возведением завода в 1925 году около Южного Чарлстона (западная Вирджиния, США) компанией "Carbide and Carbon Chemicals Co." К 1929 году этиленгликоль использовался практически всеми производителями динамита. В 1937 кампания Carbide начало первое крупномасштабное производство, основанное на газофазном окислении этилена до этиленоксида. Монополия компании Carbide на данный процесс продолжалась до 1953 года.
Получение
В промышленности этиленгликоль получают путём гидратации оксида этилена при 10 атм и 190—200°С или при 1 атм и 50—100°С в присутствии 0,1—0,5 % серной или ортофосфорной кислоты, достигая 90% выхода. Побочными продуктами при этом являются этиленгликоль, триэтиленгликоль и незначительное количество высших полимергомологов этиленгликоля.
Применение
Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике.
- Как компонент автомобильных антифризов и тормозных жидкостей, что составляет 60 % его потребления. Смесь 60 % этиленгликоля и 40 % воды замерзает при −45 °С. Коррозионно активен, поэтому применяется с ингибиторами коррозии;
- В качестве теплоносителя в виде раствора в автомобилях, в системах жидкостного охлаждения компьютеров;
- В производстве целлофана, полиуретанов и ряда других полимеров. Это второе основное применение;
- Как растворитель красящих веществ;
- В органическом синтезе:
-
- в качестве высокотемпературного растворителя.
- для защиты карбонильной группы путём получения 1,3-диоксалана. Обработкой вещества с карбонильной группой в бензоле или толуоле этиленгликолем в присутствии кислого катализатора(толуолсульфоновой кислоты, насадке Дина-Старка образующейся воды. Например, защита карбонильной группы изофорона
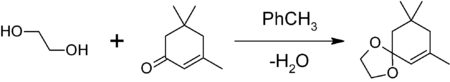
1,3-диоксоланы могут быть получены также при реакции этиленгликоля с карбонильными соединениями в присутствии триметилхлорсилана[2] или комплекса диметилсульфат-ДМФА[3] 1,3-диоксалана устойчивы к действию нуклеофилов и оснований. Легко регенерируют исходное карбонильное соединение в присутствии кислоты и воды.
- Как компонент жидкости «И», используемой для предотвращения обводнения авиационных топлив.
- В качестве криопротектора
- Для поглощения воды, для предотвращения образования гидрата метана, который забивает трубопроводы при добыче газа в открытом море. На наземных станциях его регенириуют путём осушения и удаления солей.
- Этиленгликоль является исходным сырьём для производства взрывчатого вещества нитрогликоля.
Этиленгликоль также применяется:
Очистка и осушение
Осушается молекулярным ситом 4А, полуводным сульфатом кальция, сульфатом натрия, Mg+I2, фракционной перегонкой под пониженным давлением, азеотропной отгонкой с бензолом. Чистота полученного продукта легко определяется по плотности.
Таблица плотности водных растворов этиленгликоля, 20°С
| Плотность, г/мл | 1,050 | 1,058 | 1,067 | 1,074 | 1,082 | 1,090 | 1,098 |
Меры безопасности
Этиленгликоль — горючее вещество. Температура вспышки паров 120 °C. Температура самовоспламенения 380 °C. Температурные пределы воспламенения паров в воздухе, °С: нижний — 112, верхний — 124. Пределы воспламенения паров в воздухе от нижнего до верхнего, 3,8- 6,4 % (по объему). Требования безопасности Этиленгликоль горюч, по степени воздействия на организм относится к веществам 3-го класса опасности. Этиленгликоль токсичен. Летальная доза при однократном пероральном употреблении составляет 100—300 мл этиленгликоля (1,5-5мл на 1 кг массы тела)[4]. Имеет относительно низкую летучесть при нормальной температуре, пары обладают не столь высокой токсичностью и представляют опасность лишь при хроническом вдыхании. Определённую опасность представляют туманы, однако при их вдыхании об опасности сигнализируют раздражение и кашель. Противоядием при отравлении этиленгликолем являются этанол и 4-метилпиразол (англ. Fomepizole)[5].
См. также
Примечания
Ссылки
dic.academic.ru
Формула этиленгликоля в химии
Определение и формула этиленгликоля
ОПРЕДЕЛЕНИЕЭтиленгликоль (этан-1,2-диол ) – сложное кислородсодержащее органическое соединение, двухатомный спирт.
Химическая формула – 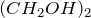
Молярная масса равна 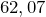 г/моль.
г/моль.
Физические свойства – это сиропообразная структура без цвета и запаха, сладкая на вкус.
По мнению большинства исторических источников, французский химик Вюрц первоначально получил этиленгликоль в 1856. Он обрабатывал йодистый этилен 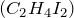 ацетатом серебра, а затем гидролизовал полученный «Этилен диацетат» гидроксидом калия. Вюрц назвал это новое соединение «гликоль», потому что ему присущи качества как этанола (с одной гидроксильной группой) так и и глицерина (с тремя гидроксильными группами).
ацетатом серебра, а затем гидролизовал полученный «Этилен диацетат» гидроксидом калия. Вюрц назвал это новое соединение «гликоль», потому что ему присущи качества как этанола (с одной гидроксильной группой) так и и глицерина (с тремя гидроксильными группами).
Химические свойства этиленгликоля
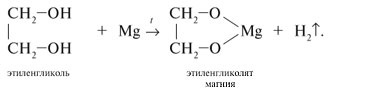
- Этиленгликоль реагирует с различными щелочными и щелочно-земельными металлами:
- В реакции с
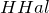 обменивают одну или несколько гидроксильных групп на атомы галогена:
обменивают одну или несколько гидроксильных групп на атомы галогена:
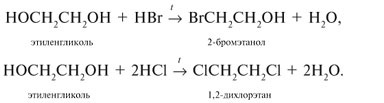
Получение
Этиленгликоль производят из этилена через промежуточное образование этиленоксида. Этиленоксид реагирует с водой с образованием этиленгликоля согласно химическому уравнению:
![Rendered by QuickLaTeX.com \[ C_2H_4O + H_2O \rightarrow HO-CH_2CH_2-OH \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-8721947d8044c86fadb059177ae600c9_l3.png)
Качественная реакция
Качественной реакцией является взаимодействие спирта со свежеосажденным  . Наблюдается растворение осадка и окрашивание раствора в насыщенно синий цвет — в результате образования гликолята меди (II).
. Наблюдается растворение осадка и окрашивание раствора в насыщенно синий цвет — в результате образования гликолята меди (II).
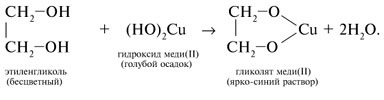
Применение
Этиленгликоль в основном используется в составе антифризов 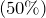 , а также в качестве сырья при производстве сложных полиэфиров, таких как полиэтилентерефталат (ПЭТ)
, а также в качестве сырья при производстве сложных полиэфиров, таких как полиэтилентерефталат (ПЭТ) 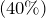 .
.
Примеры решения задач
ПРИМЕР 1| Задание | Сколько щавелевой кислоты можно получить из 6,2 г этиленгликоля? |
| Решение | Рассмотрим химическую реакцию получения щавелевой кислоты из двухатомного спирта этиленгликоля:
Из стехиометрии следует, что |
| Ответ | 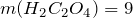 г г |

| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
что такое, применение, отравление — симптомы, лечение
 Один из типичных представителей спиртов — это этиленгликоль. Эта жидкость входит в состав многих химических средств в том числе для ухода за машинами и помещениями. Но так как этиленгликоль имеет непосредственное отношение к спиртам — его периодически пытаются выпить как заменитель алкоголя. Не все знают, что именно этот представитель обладает наиболее выраженными отравляющими качествами.
Один из типичных представителей спиртов — это этиленгликоль. Эта жидкость входит в состав многих химических средств в том числе для ухода за машинами и помещениями. Но так как этиленгликоль имеет непосредственное отношение к спиртам — его периодически пытаются выпить как заменитель алкоголя. Не все знают, что именно этот представитель обладает наиболее выраженными отравляющими качествами.
Что такое этиленгликоль, какая у него формула и физические свойства? Как его получают и где применяют? Чем опасен для организма человека этот спирт? В каких случаях происходит отравление им и что за симптомы беспокоят при этом? Как нужно действовать, чтобы помочь пострадавшему?
Что такое этиленгликоль
Этиленгликоль — это представитель спиртов с двумя метильными группами в своём составе. Но в отличие от других он имеет немного маслянистую консистенцию.
Несмотря на то что этиленгликоль был получен ещё в 1859 году, он не сразу занял свою нишу в химии и промышленности. Изначально он использовался во времена Первой мировой войны, как замена глицерина, который широко применялся при производстве взрывчатых веществ.
Химическая формула этиленгликоля — C2H6O2, рациональная — С2Н4(ОН)2. По своим физическим свойствам — это жидкость без запаха, но со сладким вкусом. Он легко соединяется с водой в любой консистенции, что успешно применяется в промышленности, ведь температура замерзания таких жидкостей очень низкая — это улучшает свойства «незамерзаек».
 У этиленгликоля есть несколько названий, которые нередко можно встретить в составе продуктов химического производства:
У этиленгликоля есть несколько названий, которые нередко можно встретить в составе продуктов химического производства:
- гликоль;
- этандиол-1,2;
- 1,2-диоксиэтан.
Чаще других употребляется основное название.
К какому классу опасности относится этиленгликоль? — к умеренно токсичное легковоспламеняющееся вещество.
Способы получения
Производством этиленгликоля в промышленных масштабах занялись ещё в тридцатые годы прошлого века. Одним из способов его получения тогда было окисление этилена до его оксида. Около 20 лет такой метод оставался единственным.
Немного позже этиленгликоль стали получать с помощью насыщения оксида этилена водой, в присутствии серной и ортофосфорной кислот. Этот способ оказался выгодней предыдущего, так как на выходе производили более 90% этиленгликоля с минимальным количеством примесей.
Где применяется
В основном этиленгликоль используют в промышленности для обработки техники, что обусловлено его стоимостью — это недорогой и всем доступный продукт.
 Он выпускается в химической промышленности для ухода за автомобилями:
Он выпускается в химической промышленности для ухода за автомобилями:
- более 50% вещества идёт на создание тормозных жидкостей и антифризов, так как смесь гликоля и воды способна сохранять жидкую консистенцию даже при 40º C ниже нуля;
- этиленгликоль входит в состав охлаждающей жидкости — тосола;
- он может устранять коррозию, поэтому гликоль добавляют в антикоррозийные химические соединения.
Где ещё используется этиленгликоль?
- Его можно обнаружить в составе антистатиков.
- Используют для производства средств защиты против обледенения.
- Служит смазкой в холодильных установках.
- Находит применение этиленгликоль как наполнитель в гидравлических системах.
- Гликоль нередко используют для дезинфекции больших помещений.
- Одно из ключевых применений вещества — это производство бытовых химических продуктов, к числу которых относится целлофан, полиуретан.
- Он используется не только при охлаждении автомобилей, но и компьютеров.
- Этиленгликоль или химические соединения в составе с ним применяется, как средство для чистки автомобильных стёкол и зеркал.
 В небольшом количестве присутствует в креме для обработки обуви.
В небольшом количестве присутствует в креме для обработки обуви.- Применяется этиленгликоль и в медицине, как составная часть криопротекторов для тканей и органов. То есть веществ, которые используют для заморозки.
- Это один из компонентов конденсаторов.
- Ключевым свойством этиленгликоля является поглощение воды, что успешно используется, чтобы предотвратить обледенение топлива в авиации и синтеза гидрата метана в трубопроводах, которые проходят в море.
- В органической химии его применяют как высокотемпературный растворитель.
- Без него не проходит синтез химических соединений.
- Где ещё используется этиленгликоль? — даже в наше время с его участием создают взрывчатые вещества.
За прошедшие десятилетия для этого двухатомного спирта нашлось множество применений, что, конечно же, обусловлено его свойствами. Но в медицине он известен не только как полезный и нужный продукт в быту, но и как средство, после контакта с которым человек может умереть.
Так что это такое этиленгликоль? — полезное химическое вещество, без которого не обходится производство большинства органических соединений или сильнодействующий яд с мощным отравляющим эффектом? Давайте узнаем, как может повлиять этиленгликоль на человека.
Влияние этиленгликоля на организм человека
Этот двухатомный спирт в основном входит в состав продуктов для ухода за помещениями, машинами и техникой. По своим физическим свойствам он отличается от привычного спирта маслянистой консистенцией и отсутствием запаха, поэтому его сложно перепутать с этанолом или изопропанолом, которые нередко употребляют внутрь. Возможны ли отравления этиленгликолем у людей? — да, несмотря на явные различия с другими спиртами отравиться им можно.

В каких случаях происходит отравление?
- Этиленгликоль является одним из средств обработки больших помещений. Во время нанесения моющих средств его пары вдыхаются, а при нарушении техники безопасности небольшое количество соединения может попасть в рот. Хотя для отравления этого недостаточно.
- Гликоль попадает внутрь при постоянной работе с ним, к примеру, если человек трудится на химическом производстве продуктов, содержащих этиленгликоль.
- Отравиться можно при случайном употреблении его внутрь.
- Так как это химическое соединение используется для обработки машин, то в группе риска находятся люди, регулярно сталкивающиеся с ним по долгу службы.
Этиленгликоль токсичен и относится к веществам третьего класса опасности. После поступления в организм человека он очень быстро всасывается в желудке и верхнем отделе тонкого кишечника. Не более 30% его выделяется в неизменном состоянии почками или в виде солей. Остальная же часть поступает в печень, где и происходит его преобразование.
В печени он разлагается до конечных продуктов:
- гликолевой кислоты;
- муравьиной и щавелевой кислоты;
- гликолевого альдегида.

Как влияет этиленгликоль на организм человека? Все эти конечные продукты распада действуют на кислотно-щелочное равновесие, что постепенно приводит к некрозу клеток головного мозга и почечной ткани. В организме развивается ацидоз или увеличение кислотности. Смертельная доза для человека составляет всего 100–150 мл. Но даже попадание небольшого количества этиленгликоля приведёт к развитию отравления, хотя и в лёгкой степени.
Симптомы отравления
В воспалительный процесс после употребления этиленгликоля вовлекаются не только почки и головной мозг. Спирт и его конечные продукты влияют на все системы органов. Скрытый период отравления этиленгликолем в среднем равен 12 часов, но он может укорачиваться или удлиняться в зависимости от количества употреблённого спирта.
 Какие симптомы отравления?
Какие симптомы отравления?
- Первый период (начальный) проявляется всего несколько часов, не более 12, и характеризуется лёгким опьянением. Человека беспокоит незначительная слабость и невнятная речь, но в целом самочувствие нормальное. В это время на отравление этиленгликолем указывает только необычный сладковатый запах, исходящий от человека. В редких случаях беспокоит тошнота, периодическая рвота, боли в животе.
- Спустя 12 часов после периода мнимого благополучия, возникает головокружение, головные боли, жажда и тошнота.
- К симптомам отравления этиленгликолем в это время относятся рвота, сильнейшие боли в желудке, которые напоминают признаки острого живота, боль в пояснице и мышцах.
- Немного позже на первое место выходят признаки поражения нервной системы: возбуждение и потеря сознания, появляются многочисленные судороги, увеличивается температура тела.
- Отравление этиленгликолем проявляется ещё и нарушением работы сердца и сосудов: увеличивается частота биения, снижается артериальное давление.
- Нарушается работа дыхательной системы: постепенно появляется одышка, поверхностное дыхание и отёк лёгких.
 Тяжёлые больные теряют сознание.
Тяжёлые больные теряют сознание.- Приблизительно на пятые сутки развивается нарушение в работе почек и печени. Из-за почечной недостаточности летальный исход наблюдается в течение одной недели.
- Смерть наступает в первые дни острого отравления из-за паралича дыхательного центра, отёка лёгких и вследствие сердечно-сосудистой недостаточности.
Лёгкое отравление этиленгликолем наблюдается чаще при вдыхании его паров небольшой концентрации. Оно проявляется незначительными симптомами: слабостью, подташниванием, головокружением.
Первая помощь при отравлении
К сожалению, часто причиной запоздалой или несвоевременной помощи становится лёгкое течение отравления, хроническая интоксикация парами этого спирта или позднее обращение пострадавшего человека к медработникам. В этом случае продукты распада гликоля уже оказывают своё повреждающее действие на внутренние органы и наносят непоправимый ущерб здоровью.

этанол — антидот при отравлении этиленгликолем
Что можно сделать на доврачебном этапе, чтобы помочь пострадавшему? Для этого необходимо быть уверенным в употреблении именно этого вещества. Если этиленгликоль был выпит недавно — нужно незамедлительно промыть желудок и ввести слабительное. Активированный уголь не окажет выраженного эффекта.
Быстро помочь при отравлении этиленгликолем, может, антидот — этанол. В этом случае применяется во внутрь его 30%-й раствор или 5%-й вводится внутривенно. А также в качестве антидота используется кальция хлорид или глюконат 10%-й раствор внутривенно или внутрь.
Не у всех под рукой могут оказаться нужные лекарства для оказания экстренных мероприятий. В этом случае неотложная помощь при отравлении этиленгликолем заключается во введении через зонд или рот обычной водки.
Если человек без сознания — его нужно уложить набок и дать доступ кислорода — открыть окно, развязать галстук и освободить от стягивающей одежды.
До момента начала активных действий нужно вызвать бригаду скорой помощи, так как пострадавшему понадобится госпитализация.
При отравлении этиленгликолем у детей нужно действовать незамедлительно и как можно скорее доставить пострадавшего малыша в ближайшую больницу!
Лечение отравления в стационаре
После госпитализации больному человеку проводят курс интенсивной терапии. Если пострадавшему не был дан антидот бригадой скорой помощи, то по прибытии в стационар его вводят сразу же.
Дальше лечение заключается в применении симптоматических препаратов для коррекции работы жизненно важных органов и систем.
 При отравлении этиленгликолем пострадавшему обеспечивают физический покой, доступ кислорода.
При отравлении этиленгликолем пострадавшему обеспечивают физический покой, доступ кислорода.- Назначают витамины группы B и C, АТФ (аденозинтрифосфорная кислота).
- При необходимости вводят преднизолон.
- При отравлении этиленгликолем назначают в большом количестве фолиевую кислоту, чтобы связать продукты распада этого двухатомного спирта.
- Вводят солевые растворы.
Профилактика отравления
Какая должна быть профилактика отравления этиленгликолем?
 При работе с химическими веществами, содержащими этиленгликоль, нужно использовать индивидуальные средства защиты.
При работе с химическими веществами, содержащими этиленгликоль, нужно использовать индивидуальные средства защиты.- Не стоит пить подозрительные жидкости.
- Хранить в недоступном для детей месте все химикаты для защиты и обработки машины, а также уборки помещений.
Этиленгликоль — насколько опасно это соединение? Нельзя недооценивать его негативное влияние на организм человека. Симптомы отравления, при попадании спирта внутрь, развиваются практически молниеносно, а смерть может наступить, спустя всего 5 дней. Отравление этиленгликолем очень легко предупредить и вылечить, если известно, что человек выпил. В противном случае терапия затягивается надолго.
otravleniy.com
Этиленгликоль

Этиленгликоль – густая бесцветная жидкость, без запаха, сладкая на вкус, ядовита. Температура плавления – 13.2°С, температура кипения 197.6°С. Плотность 1.11 г/см3, структурная формула выглядит так: HO—Ch3—Ch3—OH.
Этиленгликоль был получен в 1859 году, но повсеместно стал использоваться только в Первую мировую войну в виде замены глицерину при производстве взрывчатых веществ. Получение этиленгликоля из этилена возможно несколькими способами: путём гидратации его оксида (для этого требуется высокое давление и температура в 200 градусов) или с добавлением ортофосфорной кислоты (в этом случае на выходе получается 90% раствор).

Этиленгликоль обладает целым рядом уникальных свойств, благодаря которым применяется при производстве целого ряда незамерзающих жидкостей - водных растворов, теплоносителей и антифризов для систем отопления и промышленного холодоснабжения:
1. Хорошо растворяется в воде в любых соотношениях, с концентрацией от 0% и до 100%.
2. Придает водным растворам незамерзающие (низкозамерзающие) свойства и температура начала замерзания зависит от концентрации самого этиленгликоля в воде.
3. Обладает хорошими гигроскопическими свойствами - свойствами впитывать, поглощать влагу, воду из поверхностей и воздуха, осушая её.
4. Хорошо растворяет не растворимые или слабо растворимые друг в друге вещества - гидрофобные и гидрофильные соединения.
Этиленгликоль является активным коррозионным веществом, относится к жирным органическим соединениям, в связи с чем при производстве водных растворов - незамерзающих жидкостей необходимо использовать присадки для защиты систем от коррозии и пенообразований.
Многоатомный спирт – этиленгликоль – получил широкое применение не только в качестве антифриза, но и в качестве составляющего элемента при производстве полиуретана и целлофана.
Водный раствор этиленгликоля производится с применением антикоррозионных, противопенных и противонакипных присадок (игибиторов) и как незамерзающая жидкость благодаря своей невысокой стоимости и низкой вязкости массово применяется в системах промышленного кондиционирования (холодоснабжения) и отопления, если объекту не предъявляются высокие требования по экологичности.
При понижении температуры до температуры начала кристаллизации раствора начинается сам процесс кристаллизации, а его загустение происходит только при понижении температуры еще на 5-7 °С. Разрушение системы исключено, так как при дальнейшем понижении температуры раствор этиленгликоля превращается в гелеобразную массу.
Водный раствор на основе этиленгликоля сертифицирован, имеется сертификат соответствия и СанПин, предоставляется паспорт качества. Гарантийный срок эксплуатации - 5 лет. При замене раствор этиленгликоля подлежит утилизации, а перед заливкой нового раствора система промывается обычной водопроводной водой.
Для идентификации незамерзающие жидкости на основе этиленгликоля подкрашиваются в красно-розовый цвет.
Преимущества:
1. Страхует систему от размораживания.
2. Низкие показатели отложения солей и накипи.
3. Средняя стоимость.
Недостатки:

1. Этиленгликоль токсичен, обладает наркотическим действием. В организм всасывается быстро. Из-за токсичности растворы на этиленгликоле используется только в технических системах, где нет особых требований по экологичности.
ОПАСНО! Этиленгликоль способен проникать в организм через кожу и при вдыхании. Поэтому очень опасно применять этиленгликолевый теплоноситель в открытых системах – испарения распространятся в помещении. В двухконтурных котлах может произойти подмешивание ядовитого теплоносителя в горячую воду. При длительном воздействии возможно хроническое отравление с поражением жизненно важных органов (сосуды, почки, нервная система). Первые признаки отравления – подавленное настроение, вялость. При проглатывании происходит отек легких, развивается острая сердечная недостаточность. Специалисты называют разные цифры смертельной дозы вещества: 5 мг на кг веса тела; 50–500 мг на человека. Смертность при остром отравлении высока – более 50 %. Особо стоит помнить, что этиленгликоль не имеет неприятного запаха и обладает сладковатым вкусом, что представляет повышенную опасность для детей и животных в случае протечек теплоносителя из системы. Степень вреда, которую этиленгликоль наносит человеку, зависит от количества яда, способа проникновения и индивидуального состояния организма.
2. При разливе в жилом доме, доски пола, плитка, утеплитель, пропитанные этиленгликолевым теплоносителем подлежат обязательной замене.
3. Отработанный теплоноситель на основе этиленгликоля запрещается выливать в открытый грунт и в канализацию, его надлежит собирать и отправлять на переработку.
4. Имеет высокую вязкость при низких температурах.
5. В целях безопасности требуется постоянный контроль над системой.
Вывод: Теплоносители на основе этиленгликоля рекомендуется применять в закрытых системах отопления, с закрытым расширительным баком, для обогрева нежилых помещений с постоянным контролем над системой.
xn--e1aggc6aap.xn--p1ai
Поиск Лекций
В этих смесях при охлаждении образуются отдельные кристаллы воды, не вызывающие разрушений в системе охлаждения двигателей. При полном замерзании антифриза его объем увеличивается всего на 0,25%, в то время как объем воды – на 9%. Положительные свойства антифризов – значительно меньшие, чем у воды, удельные теплопроводность и теплоемкость. Это снижает теплопередачу в радиаторе и облегчает получение оптимального теплового режима двигателя. Применяют антифризы марок 40, 65 и концентрат марки 40 к, а также Тосол А–40, Тосол А–65 и Тосол А. Антифриз марки 40 содержит 53% гликоля и 47% воды. Температура замерзания не ниже –40 °С. Антифриз марки 65 оранжевого цвета, содержит 63% этиленгликоля и 37% воды. Эта смесь не замерзает до температуры –65 °С. Тосол А–40 и Тосол А–65 – водные растворы концентрата Тосола А, содержащего комплексные антикоррозионные и антипенные присадки. Чтобы приготовить Тосол А–40, надо взять Тосол А (температура кристаллизации –21°, плотность при 20° 13 ± 0,01 г/см3) и дистиллированную воду в объемной пропорции соответственно 53 и 47%. Плотность должна быть в пределах 1,075...1,085 г/см3. Для приготовления Тосола А–65 надо взять 65% Тосола А и 35% воды. Плотность Тосола А–65 – 1,085...1,095 г/см? Указанные пропорции следует соблюдать как можно точнее. Так, при 50%–ной концентрации обоих компонентов кристаллизация начинается при –35 °С, при 45 и 55%–ной – при –26 °С. Практически для получения Тосола А–40 надо к 1 л концентрата добавить 0,73 л воды. Антифриз готовят следующим образом. В стеклянную или пластмассовую емкость, которую предварительно промывают водой и просушивают, заливают необходимое количество этиленгликоля и добавляют дистиллированную воду. Смесь тщательно перемешивают, после чего замеряют ее плотность и при необходимости доводят до нормы (1,05...1,08г/см3). Коэффициент объемного расширения антифризов при нагревании на 5% больше, чем воды. Поэтому заправлять их необходимо в меньшем объеме. Следует учитывать, что попадание в них нефтепродуктов вызывает вспенивание и выбрасывание жидкости из системы охлаждения во время работы двигателя. В процессе применения антифриза его состав меняется в основном за счет испарения воды, так как она легче этиленгликоля. Содержание этиленгликоля остается практически постоянным. Однако в этом случае изменяются процентное соотношение компонентов и плотность антифриза, что приводит к изменению температуры замерзания. Периодичность замены антифризов, устанавливается по заводским инструкциям по пробегу (тыс.км.), или через два года. Перед заменой систему охлаждения промывают чистой водой, для чего дают проработать двигателю 10...15 мин. Этиленгликолевый антифриз перевозят и хранят в исправных герметических металлических (кроме оцинкованных) бидонах и бочках с завинчивающимися и запломбированными пробками. На таре должно быть написано "Яд" и поставлен знак ядовитых веществ. Вместо испарившихся из системы охлаждения воды и этиленгликоля в нее через впускной клапан пробки расширительного бачка поступает воздух из атмосферы. Вследствие этого в циркулирующем потоке (при уменьшении его количества в системе охлаждения) интенсивно накапливаются паровоздушные пузырьки, что ухудшает процесс теплоотдачи в радиаторе, уменьшает отвод теплоты от омываемых поверхностей и нарушает устойчивую работу насоса, снижая его подачу. Так, при уменьшении на 20% количества Тосола в системе охлаждения двигателя КАМАЗ–740 производительность насоса снижается на 38%. Это обстоятельство часто становится причиной перегревания дизеля в реальных условиях. Уменьшение объема Тосола в системе охлаждения усиливает также коррозию омываемых металлических поверхностей. В настоящее время вода для охлаждения двигателей применяется только в исключительных случаях, когда в наличии нет других типов охлаждающих жидкостей и для предотвращения аварийных ситуаций. Основным показателем воды, как охлаждающей жидкости, служит жесткость. Жесткая вода вызывает интенсивное образование накипи на внутренних стенках водяной рубашки, а также в трубках и патрубках радиаторов. Накипи ухудшают отвод тепла и способствуют перегреву отдельных участков деталей системы охлаждения, возникновению нетермических напряжений и трещин, а также повышению скорости изнашивания деталей цилиндропоршневой группы. Жесткую воду кипятят, обрабатывают химическими реагентами и проводят магнитную обработку. Один из простых способов умягчения воды – применение современных фильтрующих установок. В качестве антинакипинов используют тринатрийфосфат, гексаметафосфат (гексамет) и другие. Антинакипины взаимодействуют с солями–накипеобразователями, переводят их в легко выпадающий осадок и создают на поверхности металла пленки, защищающие металл от коррозии. Растворы антинакипинов обычно содержат на 10 дм3 воды 5…20 г тринатрийфосфата или 20…30 г гексамета Климатические условия (температура окружающего воздуха, барометрическое давление, скорость ветра) и условия производства также существенно влияют на надежность машин. Нормальной для эксплуатации машин считают температуру воздуха 5...20 °С. С ее понижением увеличиваются поломки деталей, а также отказы гидравлического и пневматического приводов машин. Заметный рост поломок основных деталей машин наблюдается с понижением температуры ниже –15 °С. Существенно возрастает число поломок и отказов машин в результате одновременного воздействия низкой температуры воздуха и скорости ветра. Количественно их влияние оценивается значением условно приведенной температуры Тус, которая подсчитывается по формуле Тус = То + Кэ υ, где То – температура окружающего воздуха, °С; Кэ – температурный эквивалент ветра, град·с/м; υ – скорость ветра, м/с. Увеличение числа поломок деталей машин с понижением температуры воздуха определяется хладостойкостью сталей и других материалов, из которых они изготовлены, а возрастание отказов гидравлического привода связано с повышением вязкости жидкости. При высокой температуре воздуха снижается вязкость масла, детали двигателей и другие сборочные единицы перегреваются. Ухудшаются условия смазывания сопряженных поверхностей, повышается скорость их изнашивания, а также возможно появление тепловых деформаций. При значительном колебании дневной и ночной температур возникают трудности в эксплуатации машин с гидравлическим приводом из–за существенного изменения вязкости масла. Барометрическое давление значительно влияет на работу двигателя. По мере увеличения высоты над уровнем моря давление воздуха падает. С понижением давления уменьшается плотность воздуха. Последнее изменяет коэффициент наполнения и степень сжатия двигателя, что приводит к неполному сгоранию смеси. В результате быстро разжижается картерное масло, ухудшаются условия смазывания цилиндров двигателя, и повышается скорость их изнашивания. Влияние производства работ на надежность машин определяется качеством разрабатываемого материала, видом нагрузки и атмосферными условиями. При разработке грунтов III и IV групп создаются значительные внешние силы, обусловливающие рост напряжений в механизмах машин. Основные причины снижения надежности машин при разработке твердых и мерзлых пород – повышение нагрузки на механизмы и их частое изменение по величине и направлению. Поэтому такие породы разрабатывают только теми машинами, которые на них рассчитаны. На надежность машин также влияет почвогрунтовая среда, в которой работают элементы машин. Интенсивность износа зависит от минералогического состава и влажности грунта, от твердости, форм и размеров абразивных частиц, давления, которое испытывает рабочий орган в процессе работы, и др. Изнашивающая способность почв оценивается коэффициентом m, который устанавливают из выражения m = Δl / Δlэт , где Δl – интенсивность износа образца почвы; Δlэт – интенсивность износа образца почвы, принятой за эталон (чистый кварцевый песок с размером частиц 0,25...0,3 мм и влажностью 0,2%). Таблица 2.5. |
|

![Rendered by QuickLaTeX.com \[ C_2H_6O_2 \rightarrow H_2C_2O_4 \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-0ca141cc729cb2fbfe9a5a79bb311e29_l3.png)
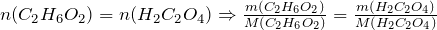
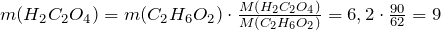 г
г