Уксусный альдегид: свойства, получение, применение. Этаналь вода
свойства, получение, применение :: SYL.ru
Введение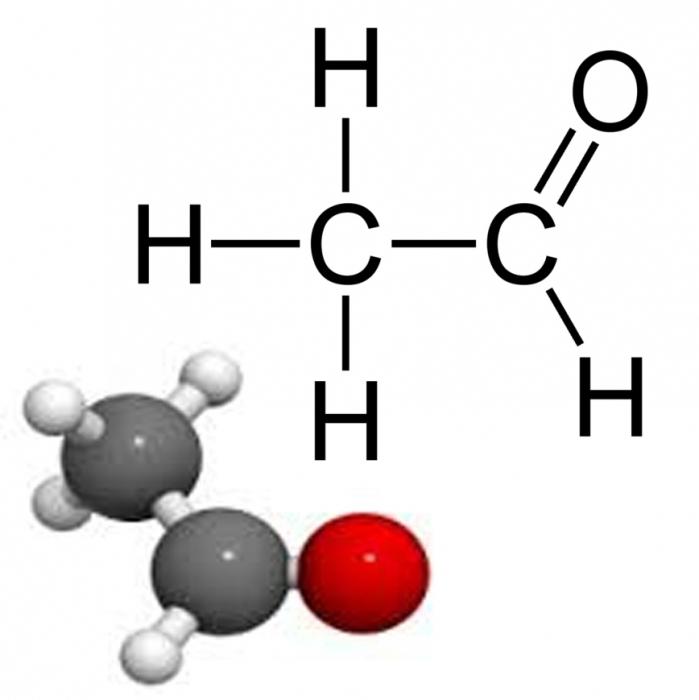
На сегодняшний день известны миллионы химических соединений. И большинство из них относится к органическим. Эти вещества делят на несколько больших групп, название одной из них - альдегиды. Сегодня мы рассмотрим представителя этого класса - уксусный альдегид.
Определение
Уксусный альдегид является органическим соединением класса альдегидов. Его могут называть и по-другому: ацетальдегидом, этаналем или метилформальдегидом. Формула уксусного альдегида - Ch4-CHO.
Свойства
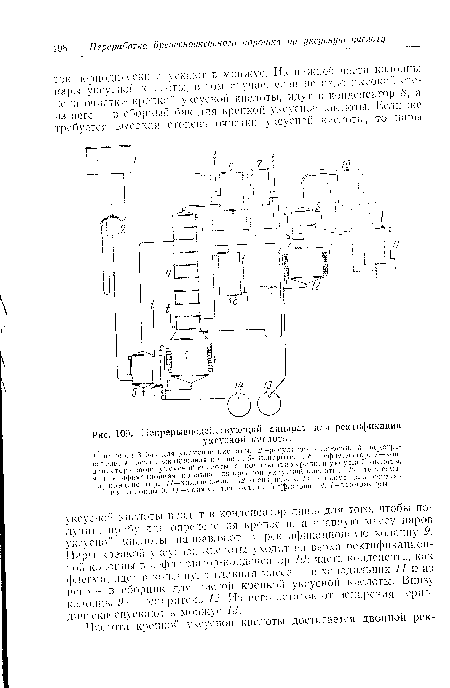
 Рассматриваемое вещество имеет вид бесцветной жидкости с резким удушливым запахом, которая хорошо растворима водой, эфиром и спиртом. Так как температура кипения обсуждаемого соединения низкая (около 20 оС), хранить и перевозить можно только его тример - паральдегид. Уксусный альдегид получают, нагрев упомянутое вещество с неорганической кислотой. Это - типичный алифатичетский аьдегид, и он может принимать участие во всех реакциях, которые характерны для данной группы соединений. Вещество имеет свойство таутомеризироваться. Этот процесс завершается образованием енола - винилового спирта. Из-за того что уксусный альдегид доступен как безводный мономер, его применяют в качестве электрофила. Вступать в реакции может как он, так и его соли. Последние, например при взаимодействии с реактивом Гриньяра и литий-органическими соединеними, образуют производные гидроксэтила. Уксусный альдегид при конденсации отличается своей хиральностью. Так, при реакции Штрекера он может конденсироваться с аммиаком и цианидами, а продуктом гидролиза станет аминокислота аланин. Еще уксусный альдегид вступает в такого же вида реакцию с другими соединениями - аминами, тогда продуктом взаимодействия становятся имины. В синтезе гетероциклических соединений уксусный альдегид является очень важным компонентом, основой всех проводящихся опытов. Паральдегид - циклический тример этого вещества - получается при конденсации трех молекул этаналя. Также уксусный альдегид может образовывать стабильные ацетали. Это происходит во время взаимодействия рассматриваемого химического вещества с этиловым спиртом, проходящего в безводных условиях.
Рассматриваемое вещество имеет вид бесцветной жидкости с резким удушливым запахом, которая хорошо растворима водой, эфиром и спиртом. Так как температура кипения обсуждаемого соединения низкая (около 20 оС), хранить и перевозить можно только его тример - паральдегид. Уксусный альдегид получают, нагрев упомянутое вещество с неорганической кислотой. Это - типичный алифатичетский аьдегид, и он может принимать участие во всех реакциях, которые характерны для данной группы соединений. Вещество имеет свойство таутомеризироваться. Этот процесс завершается образованием енола - винилового спирта. Из-за того что уксусный альдегид доступен как безводный мономер, его применяют в качестве электрофила. Вступать в реакции может как он, так и его соли. Последние, например при взаимодействии с реактивом Гриньяра и литий-органическими соединеними, образуют производные гидроксэтила. Уксусный альдегид при конденсации отличается своей хиральностью. Так, при реакции Штрекера он может конденсироваться с аммиаком и цианидами, а продуктом гидролиза станет аминокислота аланин. Еще уксусный альдегид вступает в такого же вида реакцию с другими соединениями - аминами, тогда продуктом взаимодействия становятся имины. В синтезе гетероциклических соединений уксусный альдегид является очень важным компонентом, основой всех проводящихся опытов. Паральдегид - циклический тример этого вещества - получается при конденсации трех молекул этаналя. Также уксусный альдегид может образовывать стабильные ацетали. Это происходит во время взаимодействия рассматриваемого химического вещества с этиловым спиртом, проходящего в безводных условиях.
Получение
В основном уксусный альдегид получают с помощью окисления этилена (процесс Вакера). В роли окислителя выступает хлорид палладия. Еще данное вещество можно получить во время гидратации ацетилена, в которой присутствуют соли ртути. Продуктом реакции является енол, который изомеризуется в искомое вещество. Еще один способ получения уксусного альдегида, который был наиболее популярным задолго до того, как стал известен процесс Вакера, - окисление или дегидратация этанола в присутствии медного или серебряного катализаторов. При дегидратации, помимо искомого вещества, образуется водород, а во время окисления - вода.
Применение
С помощью обсуждаемого соединения получают бутадиен, альдегидные полимеры и некоторые органические вещества, в том числе и одноименную кислоту. Она образуется при его окислении. Реакция выглядит так: "кислород + уксусный альдегид = уксусная кислота". Этаналь - важный прекурсор ко многим производным, и это свойство широко применяется в синтезе многих веществ. В организмах человека, животных и растений ацетальдегид является участником некоторых сложных реакций. Также он входит в состав сигаретного дыма.
Заключение
Ацетальдегид может приносить как пользу, так и вред. Он плохо воздействует на кожу, является ирритантом и, возможно, канцерогеном. Поэтому его присутствие в организме нежелательно. Но некоторые люди сами провоцируют появление ацетальдегида, куря сигареты и употребляя алкоголь. Подумайте над этим!
www.syl.ru
Уксусный альдегид. Физические и термические свойства. Получение и применение
Уксусный альдегид (другие названия: ацетальдегид, метилформальдегид, этаналь) - это органическое соединение, принадлежащее к классу альдегидов. Это вещество имеет важное значение для человека, оно встречается в кофе, хлебе, спелых фруктах и овощах. Синтезируется растениями. Встречается в природе и производится в больших количествах человеком. Формула уксусного альдегида: Ch4-CHO.
Физические свойства
1. Уксусный альдегид – это жидкость без цвета, имеющая резкий неприятный запах.2. Хорошо растворяется в эфире, спирте и воде.3. Молярная масса составляет 44,05 грамм/моль.4. Плотность равна 0,7 грамм/сантиметр³.
Термические свойства
1. Температура плавления равна -123 градусам.2. Температура кипения составляет 20 градусов.3. Температура воспламенения равна -39 градусам.4. Температура самовоспламенения составляет 185 градусов.
Получение уксусного альдегида
1. Основной способ получения этого вещества заключается в окислении этилена (так называемый процесс Вакера). Так выглядит эта реакция:2Ch3 = C2h5 (этилен) + O2 (кислород) = 2Ch4CHO (метилформальдегид)
2. Также уксусный альдегид можно получить посредством гидратации ацетилена в присутствии ртутных солей (так называемая реакция Кучерова). При этом получается фенол, который затем изомеризуется в альдегид.
3. Следующий метод был популярным до появления вышеописанного процесса. Выполнялся путем окисления или дегидрирования этилового спирта на серебряном или медном катализаторе.
Применение уксусного альдегида
- Для получения каких веществ нужен уксусный альдегид? Уксусная кислота, бутадиен, альдегидные полимеры и некоторые другие органические вещества.- Используется в качестве прекурсора (вещество, которое участвует в реакции, приводящей к созданию целевого вещества) к уксусной кислоте. Однако так применять рассматриваемое нами вещество вскоре перестали. Это произошло по той причине, что уксусную кислоту проще и дешевле производить из металона при помощи процессов Катива и Монсанто.- Метилформальдегид – важный прекурсор к пентаэритролу, пиридиновым производным и кротоналдегиду.- Получение смол в результате того, что мочевина и уксусный альдегид имеют способность конденсироваться.- Получение этилидендиацетата, из которого в дальнейшем производят мономер поливинилацетат (винилацетат).
Табачная зависимость и уксусный альдегид
Данное вещество – это значительная часть табачного дыма. Недавно была проведена демонстрация, на которой было показано, что синергическая связь уксусной кислоты с никотином увеличивает проявление зависимости (особенно у лиц до тридцати лет).
Болезнь Альцгеймера и уксусный альдегид
Те люди, у которых нет генетического фактора конверсии метилформальдегида в уксусную кислоту, имеют высокий риск предрасположенности к такому заболеванию, как сенильная деменция (или болезнь Альцгеймера), которая обычно возникает в старческом возрасте.
Алкоголь и метилформальдегид
Предположительно рассматриваемое нами вещество является канцерогеном для человека, так как на сегодняшний день существуют доказательства канцерогенности уксусного альдегида в различных экспериментах на животных. Кроме этого, метилформальдегид повреждает ДНК, вызывая тем самым несоразмерное с массой тела развитие мышечной системы, которое связано с нарушением обмена белка в организме. Было проведено исследование 800 алкоголиков, в результате которого ученые пришли к выводу, что у людей, подвергшихся воздействию уксусного альдегида, есть дефект в гене одного фермента – алкогольдегидрогеназы. По этой причине такие пациенты больше подвержены риску развития онкологического заболевания почек и верхней части печени.
Безопасность
Данное вещество токсично. Является загрязнителем атмосферы при курении или от выхлопов в автомобильных пробках.
fb.ru
1. Общие сведения
1.1. Физические свойства
Ацетальдегид (этаналь, уксусный альдегид) СН3СНО представляет бесцветную легкокипящую жидкость с резким удушливым запахом, с температурой кипения 20,2оС, температурой плавления –123,5оС и плотностью 0,783 т/м3. Критическая температура ацетальдегида 188оС, температура воспламенения 156оС. В воздухом ацетальдегид образует взрывчатые смеси с пределами воспламеняемости при 400оС 3,97 и 57% об. Смеси с кислородом воспламеняются при более низкой температуре – около 140оС. Токсичен, ПДК составляет 5 мг/м3.
Ацетальдегид смешивается во всех отношениях с водой, этанолом, диэтиловым эфиром и другими органическими растворителями, с некоторыми образует азеотропные смеси.
Ацетальдегид – соединение, в молекуле которого карбонильная группа связана с углеводородным радикалом и атомом водорода (СН3 – СН=О). Ацетальдегид не образует водородных связей, поэтому температура его кипения значительно ниже, чем у соответствующих спиртов.
1.1.1 Физические свойства ацетилена
Ацетилен (этин) C2h3 – это бесцветный газ, обладающий в чистом виде слабым эфирным запахом, с температурой кипения –83,8оС, температурой плавления –80,8оС (при 0,17 МПа) и плотностью 1,09 кг/м3. Критическая температура ацетилена 35,5оС.
При нагревании до 500оС и при сжатии до давлений выше 2*105 Па ацетилен, даже в присутствии кислорода, разлагается со взрывом. Разложение инициируется искрой и трением. Взрывоопасность ацетилена возрастает в контакте с металлами, способными образовывать ацетилениды, например, с медью. Это необходимо учитывать при выборе материала аппаратуры. С воздухом ацетилен образует взрывчатые смеси с пределами воспламенения 2,3 и 80,7 % об. При этом взрывоопасность смесей снижается при разбавлении их инертными газами (азот, метан) или парами.
Ацетилен значительно лучше, чем другие газообразные углеводороды, растворим в воде. При температуре 15оС и давлении 105 Па в одном объеме воды растворяется 1,15 объемов. В других растворителях растворимость ацетилена составляет: в ацетоне 25, этаноле 6, бензоле 4, уксусной кислоте 6 объемов. Растворимость в ацетоне возрастает с повышением давления и при 1,25 МПа составляет уже 300 объемов в одном объеме. Растворимость ацетилена в различных растворителях имеет большое значение для его выделения из смесей с другими газами, а также при хранении в баллонах в виде раствора и в ацетоне.
Ацетилен является эндотермическим соединением с энтальпией образования +227,4 кДж/моль. Поэтому при сгорании его в кислороде выделяется большое количество тепла и развивается высокая температура, достигающая 3150оС.
1.2. Химические свойства
1. Под воздействием минеральных кислот ацетальдегид полимеризуется с образованием жидкого циклического тримера – паральдегида с температурой кипения 124,4оС и температурой плавления 12,6оС:



3СН3СНО СН3СН – О- СН(СН3)- О- СН(СН3)-О
ацетальдегид тример-паральдегид
и кристаллического тетрамера – метальдегида:
4СН3СНО(СН3СНО)4,
ацетальдегид тетрамер-метальдегид
которые при нагревании с серной кислотой деполимеризуются до исходного ацетальдегида. На этом основано использование во многих случаях паральдегида вместо мономерного ацетальдегида, так как он более удобен при хранении и транспортировке.
2. Присоединение циановодородной (синильной) кислоты. Ацетальдегид взаимодействуя с синильной кислотой образует оксикислоту:
КСN
СН3СНО+НСNСН3СНОН-СN
ацетальдегид синильная оксикислота
кислота
Эта реакция является реакцией нуклеофильного присоединения по двойной связи С=О, она используется для удлинения углеродной цепи и получения оксикислот
3. Гидрирование – это химический процесс, связанный с присоединением молекулы водорода к ацетальдегиду.В данной реакции присоединение водорода идет по по ненасыщенным связям с образованием этанола:
СН3СНО+Н2СН3СН2ОН
ацетальдегид этиловый спирт (этанол)
4. Реакция «серебряного зеркала» - окисление ацетальдегида аммиачным раствором оксида серебра, с образованием соли уксусной кислоты (ацетата), серебра (в виде осадка), аммиака и воды:
СН3СНО+2[Ag(Nh4)2]OHСН3СООNh5+2Ag+3Nh4+h3O
ацетальдегид аммиачный раствор ацетат аммиак
оксида серебра
5. Окисление гидроксидом меди (II). Ацетальдегид взаимодействует с гидроксидом меди с образованием уксусной кислоты оксида меди и воды:
СН3СНО+2Сu(ОН)2СН3СООН+СuO+2Н2О
ацетальдегид гидроксид уксусная оксид
меди кислота меди
СuO – осадок красного цвета.
6. Взаимодействие со спиртами с образованием ацеталей и полуацеталей. Полуацетали – соединения, в которых атом углерода связан с гидроксильной и алкоксильной группами. Ацетали - соединения, в которых атом углерода связан с двумя алкоксильными группами:
СН3-СН=О+2СН3ОНСН3-СН-ОСН3 + Н2О
ацетальдегид метанол
ОСН3
ацеталь
7. Присоединение гидросульфита натрия (NaHSO3) c образованием гидросульфитных производных альдегидов:
Ch4 Ch4 O
\ \ /
С=О+НSO3Na C
/ / \
H H SO3Na
гидросульфитное производное этаналя
1.2.1 Химические свойства ацетилена
В молекуле ацетилена содержатся два активных фрагмента: тройная связь -СС- и подвижный «ацетиленовый» атом водородаС-Н. В соответствии с этим реакции ацетилена могут быть сведены к двум основным типам:реакции винилирования; реакции с участием «ацетиленового» атома водорода.
1. Реакции присоединения – общие для всех алкинов. Реакция Кучерова приводит к образованию ацетальдегида:
Нg2+,Н+
НССН+Н2О[СН2=СН-ОН] СН3-СН=О.
2. Слабые кислотные свойства:
2 НССН+2Na2NaССna+h3
НССН+2[Ag(Nh4)2]OHAgCCAg+4Nh4+2h3O.
Соли ацетилена называют ацетиленидами. Ацетилениды легко разалагаются при действии соляной кислоты:
AgCCag+HClНССН+2AgCl.
3. Полимеризация:
а) димеризация под действием водного раствора CuClиNh5Cl:
НССН+НССНСН2=СН-ССН
Винилацетилен
б) тримеризация (реакция Зелинского) с образованием бензола:
600оС
3НССНС6Н6
studfiles.net
Ацетальдегид - это... Что такое Ацетальдегид?
Ацетальдеги́д (у́ксусный альдегид, этана́ль, метилформальдегид) — органическое соединение класса альдегидов с химической формулой Ch4-CHO.
Это один из наиболее важных альдегидов, широко встречающийся в природе и производящийся в больших количествах индустриально. Ацетальдегид встречается в кофе, в спелых фруктах, хлебе, и синтезируется растениями как результат их метаболизма. Также производится окислением этанола.Физические свойства
Вещество представляет собой бесцветную жидкость с резким запахом, хорошо растворяется в воде, спирте, эфире. Из-за очень низкой температуры кипения (20,2 °C) хранят и перевозят ацетальдегид в виде тримера — паральдегида, из которого он может быть получен нагреванием с минеральными кислотами (обычно серной).
Получение
В 2003 глобальное производство было около миллиона тонн в год. Основной способ получения — окисление этилена (процесс Вакера[1]):

В качестве окислителя В процессе Вакера используется хлорид палладия, регенерирущийся окислением хлоридом меди в присутствии кислорода воздуха:



Также получают уксусный альдегид гидратацией ацетилена в присутствии солей ртути (реакция Кучерова), с образованием енола, который изомеризуется в альдегид:

Этот метод раньше доминировал до появления процесса Вакера[1] окислением или дегидрированием этилового спирта, на медном или серебряном катализаторе.
![\mathsf{C_2H_5OH \xrightarrow[]{Ag, ^oC} CH_3CHO + H_2}](/800/600/http/dic.academic.ruaf3bcef446652d07324fdd7037598a97.png)
![\mathsf{2C_2H_5OH + O_2 \xrightarrow[]{Ag, ^oC} 2CH_3CHO + 2H_2O}](/800/600/http/dic.academic.ru07ba78240ceeaec5e4188860eda0c330.png)
Реакционная способность
По своим химическим свойствам уксусный альдегид является типичным алифатическим альдегидом и для него характерны реакции этого класса соединений. Его реакционная способность определяется двумя факторами — активностью карбонила альдегидной группы и подвижностью атомов водорода метильной группы вследствие индуктивного эффекта карбонила. Подобно другим карбонильным соединениям с атомами водорода у α-углеродного атома, ацетальдегид таутомеризуется, образуя енол — виниловый спирт, равновесие почти полностью смещено в сторону альдегидной формы (константа равновесия — только 6·10−5 при комнатной температуре[2]):

Реакция конденсации
Из-за маленьких размеров и доступности в виде безводного мономера (в отличие от формальдегида) является широко распространённым электрофилом в органическом синтезе.[3] Что касается реакций конденсации, альдегид прохирален. Используется, в основном, как источник синтона «Ch4C+H(OH)» в альдольной и соответствующих реакциях конденсации. Реактив Гриньяра и литий-органические соединения реагируют с MeCHO, образуя производные гидроксэтила. В одной из очень интересных реакций конденсации, три эквивалента формальдегида присоединяются, а один восстанавливает образующийся альдегид, образуя из MeCHO пентаэритрит (C(Ch3OH)4.)
В реакции Штрекера[4] ацетальдегид конденсируется с цианидом и аммиаком, образуя после гидролиза аминокислоту — аланин[5]. Ацетальдегид способен конденсироваться с аминами образуя имины, так как конденсация циклогексиламина даёт N-этилиденциклогексиламин. Эти имины могут быть использованы для прямой последующей реакции, таких, как альдольная конденсация.[6] Ацетальдегид также — важный строительный блок для синтезов гетероциклических соединений. Выдающийся пример — конверсия под действием аммиака до 5-этил-2-метилпиридина («альдегид-коллидин»)[7]
Реакция альдольной конденсации обусловлена подвижностью водорода в альфа-положении в радикале и осуществляется в присутствии разбавленных щелочей. Ее можно рассматривать как реакцию нуклеофильного присоединения одной молекулы альдегида к другой: Ch4-Ch3-CH=O + Ch4-Ch3-CH=O → Ch4-Ch3-CH(OH)-CH(Ch4)-CH=O +(OH)- Продукт- 2-метил-3-гидроксипентаналь.
Производные ацеталя
Три молекулы ацетальдегида конденсируются, образуя «паральделгид» — циклический тример, содержащий одиночные С-О связи. Конденсация четырёх молекул даёт циклическое соединение, называемое метальдегид.
Ацетальдегид образует стабильные ацетали при реакции с этанолом в условиях дегидратации. Продукт Ch4CH(OCh3Ch4)2 называется «ацеталь»[8], хотя термин используется для описания более широкой группы соединений с общей формулой RCH(OR')2.
Применение
Применяют уксусный альдегид для получения уксусной кислоты, бутадиена, некоторых органических веществ, альдегидных полимеров.
Традиционно ацетальдегид, в основном, использовался в качестве прекурсора к уксусной кислоте. Такое применение было отвергнуто ввиду того, что уксусная кислота более эффективно производится из метанола с помощью процессов Монсанто[9] и Катива[10]. В терминах реакции конденсации, ацетальдегид — важный прекурсор к пиридиновым производным, пентаэритролу и кротоналдегиду. Мочевина и ацетальдегид конденсируются, образуя смолы. Уксусный ангидрид реагирует с ацетальдегидом, давая этилидендиацетат, из которого получают винилацетат — мономер поливинилацетат.
Биохимия
В печени энзим алкогольдегидрогеназа окисляет этанол в ацетальдегид, который затем далее окисляется в безопасную уксусную кислоту посредством ацетальдегиддегидрогеназы. Эти две реакции окисления связаны с восстановлением NAD+ в NADH[11]. В мозгу алкогольдегидрогеназа не играет особой роли в окислении этанола в ацетальдегид, это делает энзим каталаза. Конечные шаги алкогольной ферментации в бактериях, растениях и дрожжах включают конверсию пирувата в ацетальдегид под действием пируват декарбоксилаза, после чего — конверсию ацетальдегида в этанол. Последняя реакция снова катализируется алкогольдегидрогеназой, но уже в обратном направлении.
Табачная зависимость
Ацетальдегид — значительная часть дыма табака. Была продемонстрирована синергическая связь с никотином, увеличивающая появление зависимости, особенно у молодёжи.[12][13]
Альцгеймерова болезнь
Люди, у которых отсутствует генетический фактор конверсии ацетальдегида в уксусную кислоту, могут иметь большой риск предрасположенности к болезни Альцгеймера. «Эти результаты указывают что отсутствие ALDh3 — это фактор риска для поздно возникающей болезни Альцгеймера.»[14]
Проблема алкоголя
Ацетальдегид, полученный из поглощённого этанола, связывает ферменты, образуя аддукты, связанные с заболеваниями органов.[15] Лекарство дисульфирам (Antabuse) предотвращает окисление ацетальдегида до уксусной кислоты. Это даёт неприятные ощущения при принятии алкоголя. Antabuse используется в случае, когда алкоголик сам хочет излечиться.
Канцероген
Ацетальдегид предположительно является канцерогеном для человека.[16] «Существует достаточно доказательств канцерогенности ацетальдегида (основного метаболита этанола) в экспериментах на животных», кроме того, ацетальдегид повреждает ДНК[17] и вызывает несоразмерное с общей массой тела развитие мускулов, связанное с нарушением белкового равновесия организма.[18] В результате исследования 818 алкоголиков ученые пришли к выводу, что у тех пациентов, которые подвергались действию ацетальдегида в большей степени, присутствует дефект в гене фермента алкогольдегидрогеназы. Поэтому такие пациенты подвержены большему риску развития рака верхней части ЖКТ и печени.[19]
Безопасность
Ацетальдегид токсичен при действии на кожу, ирритант и, возможно, канцероген. Он также является загрязнителем воздуха при горении, курении, в автомобильных выхлопах. Он также образуется при термической обработке полимеров и пластиков.[20]
Врожденная непереносимость алкоголя
Одним из механизмов врожденной непереносимости алкоголя является накопление ацетальдегида.
Примечания
- ↑ 1 2 en:Wacker process
- ↑ March, J. «Organic Chemistry: Reactions, Mechanisms, and Structures» J. Wiley, New York: 1992. ISBN 0-471-58148-8.
- ↑ Sowin, T. J.; Melcher, L. M. «Acetaldehyde» in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI:10.1002/047084289
- ↑ en:Strecker amino acid synthesis
- ↑ Kendall, E. C. McKenzie, B. F. (1941), «dl-Alanine», Org. Synth.; Coll. Vol. 1: 21
- ↑ Wittig, G.; Hesse, A. (1988), «Directed Aldol Condensations: β-Phenylcinnamaldehyde», Org. Synth.; Coll. Vol. 6: 901
- ↑ Frank, R. L.; Pilgrim, F. J.; Riener, E. F. (1963), «5-Ethyl-2-Methylpyridine», Org. Synth.; Coll. Vol. 4: 451
- ↑ Adkins, H.; Nissen, B. H. (1941), «Acetal», Org. Synth.; Coll. Vol. 1: 1
- ↑ en:Monsanto process
- ↑ en:Cativa process
- ↑ NAD+ to NADH Hipolito, L.; Sanchez, M. J.; Polache, A.; Granero, L. Brain metabolism of ethanol and alcoholism: An update. Curr. Drug Metab. 2007, 8, 716—727
- ↑ Study Points to Acetaldehyde-Nicotine Combination in Adolescent Addiction
- ↑ Nicotine’s addictive hold increases when combined with other tobacco smoke chemicals, UCI study finds
- ↑ «Mitochondrial ALDh3 Deficiency as an Oxidative Stress». Annals of the New York Academy of Sciences 1011: 36-44. April 2004. doi:10.1196/annals.1293.004. PMID 15126281. Retrieved 2009-08-13.
- ↑ Nakamura, K.; Iwahashi, K.; Furukawa, A.; Ameno, K.; Kinoshita, H.; Ijiri, I.; Sekine, Y.; Suzuki, K.; Iwata, Y.; Minabe, Y.; Mori, N. Acetaldehyde adducts in the brain of alcoholics. Arch. Toxicol. 2003, 77, 591.
- ↑ Chemical Summary For Acetaldehyde, US Environmental Protection Agency
- ↑ DNA and chromosome damage induced by acetaldehyde in human lymphocytes in vitro
- ↑ ^ Nicholas S. Aberle, II, Larry Burd, Bonnie H. Zhao and Jun Ren (2004). «Acetaldehyde-induced cardiac contractile dysfunction may be alleviated by vitamin В1 but not by vitamins B6 or B12». Alcohol & Alcoholism 39 (5): 450—454. doi:10.1093/alcalc/agh085.
- ↑ Nils Homann, Felix Stickel, Inke R. König, Arne Jacobs, Klaus Junghanns, Monika Benesova, Detlef Schuppan, Susanne Himsel, Ina Zuber-Jerger, Claus Hellerbrand, Dieter Ludwig, Wolfgang H. Caselmann, Helmut K. Seitz Alcohol dehydrogenase 1C*1 allele is a genetic marker for alcohol-associated cancer in heavy drinkers International Journal of Cancer Volume 118, Issue 8, Pages 1998—2002
- ↑ Smoking. (2006). Encyclopædia Britannica. Accessed 27 Oct 2006.
dic.academic.ru
- Этаналь

- Пропаналь

- Бутаналь

Спирты в результате присоединения к альдегидам и кетонам образуют с одной молекулой спирта неустойчивые полуацетали и полукетали, с двумя — устойчивые ацетали и кетали. Реакции образования полуацеталей катализируются кислотами и основаниями. Эта реакция обратима — ацетали гидролизуются под действием кислот.
Механизм реакции обратен механизму гидролиза ацеталей.

Ацетали образуются при действии избытка спирта только в кислой среде. Обратная реакция гидролиза ацеталей тоже катализируется кислотами.

При щелочном гидролизе уходящая группа (RO–) является очень плохой, и реакция невозможна. Это свойство — устойчивость ацеталей в щелочной среде — используется, когда необходимо защитить карбонильную группу.
5.Напишите схемы реакций взаимодействия:
- бензальдегида с метиламином
- бутаналя с метантиолом в мольном отношении 1:2
- бутаналя с этиламином
- пропаналя с гидроксиламином
Опишите механизм реакций. Способны ли гидролизоваться полученные соединения? Напишите схемы реакций гидролиза.
Решение




Имины, оксимы по реакциям, обратным их образованию могут подвергаться гидролизу водными кислотами. Гидролиз можно рассматривать как катализируемое кислотами присоединение воды к гетероаналогу карбонильного соединения.
Тиоацетали, также могут быть подвергнуты гидролизу.




Карбонильная группа содержит двойную углерод-кислородную связь; поскольку подвижные π-электроны сильно оттянуты к кислороду, углерод карбонильной группы является электрон-дефицитным центром, а кислород карбонильной группы — электроноизбыточным.
Поскольку важнейшая стадия в этих реакциях — образование связи с электронодефецитным (кислым) карбонильным углеродом, то карбонильная группа более всего склонна к взаимодействию с электроноизбыточными нуклеофильными реагентами, т. е. с основаниями. Типичными реакциями альдегидов и кетонов будут реакции нуклеофильного присоединения.

В переходном состоянии кислород начинает приобретать электроны и отрицательный заряд, который он будет иметь в конечном продукте. Именно тенденция кислорода приобретать электроны, точнее его способность нести отрицательный заряд, и является действительной причиной реакционной способности карбонильной группы по отношению к нуклеофилам.

Оксимы и тиоацетали образуются по этому механизму.
6.Напишите схемы реакций альдольной конденсации
- этаналя
- 2-метилпропаналя
- бутаналя
- пентаналя
Опишите механизмы реакций, объясните причину появления CH- кислотного центра.
Решение
На присоединении сопряженного карбаниона генерированного из альдегида или кетона, к карбонильной группе основывается важная реакция — альдольная конденсация (правильнее было бы называть эту реакцию альдольным присоединением):

В некоторых случаях альдольное присоединение происходит в присутствии кислого катализатора. При этом нейтральный и слабый С-нуклеофил — енол — присоединяется к активированной карбонильной группе.
Для проведения реакций используют слабощелочную среду.




Ионизация α-водородного атома

приводит к карбаниону I, представляющему собой резонансный гибрид двух структур (II и III), резонанс которых возможен лишь при участии карбонильной группы

Резонанс подобного типа невозможен для карбанионов, образующихся при ионизации β- и γ-водородных атомов и т. д. в насыщенных карбонильных соединениях.
Таким образом, карбонильная группа влияет на кислотность α-водородных атомов точно так же, как она влияет на кислотность карбоновых кислот: группа С=О участвует в делокализации отрицательного заряда аниона

Альдегидная группа обладает также отрицательным индуктивным эффектом (–I), что также влияет на усиление кислотных свойств α-водородных атомов.
α-Водородные атомы карбонильных соединений все же слабо кислые, хотя и обладают кислотностью достаточной для того, чтобы они отрывались при действии основных реагентов. Поэтому образующиеся карбанионы будут сильными основаниями и исключительно реакционноспособными частицами. В реакциях они ведут себя, как и следовало ожидать, как нуклеофилы.
7.Напишите схемы внутримолекулярных превращений, которым подвергаются в кислой среде:
- 4-гидрокси - 3-метилпентаналя
- 5-гидроксигексаналя
Опишите механизм реакций. В чём причина этого внутримолекулярного взаимодействия? Способны ли гидролизоваться полученные соединения?
Решение
γ- и δ-Гидроксикарбонильные соединения легко образуют продукты внутримолекулярного взаимодействия гидроксильной группы с карбонильной — циклические полуацетали. Эти соединения могут существовать в форме с открытой цепью и в циклической полуацетальной форме. Такое явление называется кольчато-цепнойизомерией. В отдельных случаях наблюдается равновесие между циклическими и открытыми формами.
γ-Гидроксикарбонильные соединения образуют производные тетрагидрофурана.
δ-Гидроксикарбонильные соединения образуют цикл тетрагидропирана, точнее производные 2-гидрокситетрагидропирана, в которых появляется асимметрический атом углерода.

Это реакции внутримолекулярного нуклеофильного присоединения с кислотным катализом.

Гидролиз этих соединений протекать не может, так как в процессе реакции не образовывалось воды (вода не отщеплялась).
8.Напишите схемы реакций получения:
- полного этилового эфира бутандиовой кислоты из бутандиовой кислоты
- полного амида бутандиовой кислоты из полного метилового эфира той же кислоты
- метилацетата из соответствующей карбоновой кислоты и ангидрида
- ацетамида из соответствующих функциональных производных: сложного эфира и ангидрида
- метилацетата по реакции этерификации
- сложного эфира из бутановой кислоты и этилового спирта
- пропанамида из различных ацилирующих агентов: кислоты, ангидрида, сложного эфира
- ангидридов бутановой и бутандиовой кислот из соответствующих кислот
Опишите механизмы реакций. Объясните необходимость катализатора в реакции этерификации.
Решение
studfiles.net
- Этаналь

- Пропаналь

- Бутаналь

Спирты в результате присоединения к альдегидам и кетонам образуют с одной молекулой спирта неустойчивые полуацетали и полукетали, с двумя — устойчивые ацетали и кетали. Реакции образования полуацеталей катализируются кислотами и основаниями. Эта реакция обратима — ацетали гидролизуются под действием кислот.
Механизм реакции обратен механизму гидролиза ацеталей.

Ацетали образуются при действии избытка спирта только в кислой среде. Обратная реакция гидролиза ацеталей тоже катализируется кислотами.

При щелочном гидролизе уходящая группа (RO–) является очень плохой, и реакция невозможна. Это свойство — устойчивость ацеталей в щелочной среде — используется, когда необходимо защитить карбонильную группу.
5.Напишите схемы реакций взаимодействия:
- бензальдегида с метиламином
- бутаналя с метантиолом в мольном отношении 1:2
- бутаналя с этиламином
- пропаналя с гидроксиламином
Опишите механизм реакций. Способны ли гидролизоваться полученные соединения? Напишите схемы реакций гидролиза.
Решение




Имины, оксимы по реакциям, обратным их образованию могут подвергаться гидролизу водными кислотами. Гидролиз можно рассматривать как катализируемое кислотами присоединение воды к гетероаналогу карбонильного соединения.
Тиоацетали, также могут быть подвергнуты гидролизу.




Карбонильная группа содержит двойную углерод-кислородную связь; поскольку подвижные π-электроны сильно оттянуты к кислороду, углерод карбонильной группы является электрон-дефицитным центром, а кислород карбонильной группы — электроноизбыточным.
Поскольку важнейшая стадия в этих реакциях — образование связи с электронодефецитным (кислым) карбонильным углеродом, то карбонильная группа более всего склонна к взаимодействию с электроноизбыточными нуклеофильными реагентами, т. е. с основаниями. Типичными реакциями альдегидов и кетонов будут реакции нуклеофильного присоединения.

В переходном состоянии кислород начинает приобретать электроны и отрицательный заряд, который он будет иметь в конечном продукте. Именно тенденция кислорода приобретать электроны, точнее его способность нести отрицательный заряд, и является действительной причиной реакционной способности карбонильной группы по отношению к нуклеофилам.

Оксимы и тиоацетали образуются по этому механизму.
6.Напишите схемы реакций альдольной конденсации
- этаналя
- 2-метилпропаналя
- бутаналя
- пентаналя
Опишите механизмы реакций, объясните причину появления CH- кислотного центра.
Решение
На присоединении сопряженного карбаниона генерированного из альдегида или кетона, к карбонильной группе основывается важная реакция — альдольная конденсация (правильнее было бы называть эту реакцию альдольным присоединением):

В некоторых случаях альдольное присоединение происходит в присутствии кислого катализатора. При этом нейтральный и слабый С-нуклеофил — енол — присоединяется к активированной карбонильной группе.
Для проведения реакций используют слабощелочную среду.




Ионизация α-водородного атома

приводит к карбаниону I, представляющему собой резонансный гибрид двух структур (II и III), резонанс которых возможен лишь при участии карбонильной группы

Резонанс подобного типа невозможен для карбанионов, образующихся при ионизации β- и γ-водородных атомов и т. д. в насыщенных карбонильных соединениях.
Таким образом, карбонильная группа влияет на кислотность α-водородных атомов точно так же, как она влияет на кислотность карбоновых кислот: группа С=О участвует в делокализации отрицательного заряда аниона

Альдегидная группа обладает также отрицательным индуктивным эффектом (–I), что также влияет на усиление кислотных свойств α-водородных атомов.
α-Водородные атомы карбонильных соединений все же слабо кислые, хотя и обладают кислотностью достаточной для того, чтобы они отрывались при действии основных реагентов. Поэтому образующиеся карбанионы будут сильными основаниями и исключительно реакционноспособными частицами. В реакциях они ведут себя, как и следовало ожидать, как нуклеофилы.
7.Напишите схемы внутримолекулярных превращений, которым подвергаются в кислой среде:
- 4-гидрокси - 3-метилпентаналя
- 5-гидроксигексаналя
Опишите механизм реакций. В чём причина этого внутримолекулярного взаимодействия? Способны ли гидролизоваться полученные соединения?
Решение
γ- и δ-Гидроксикарбонильные соединения легко образуют продукты внутримолекулярного взаимодействия гидроксильной группы с карбонильной — циклические полуацетали. Эти соединения могут существовать в форме с открытой цепью и в циклической полуацетальной форме. Такое явление называется кольчато-цепнойизомерией. В отдельных случаях наблюдается равновесие между циклическими и открытыми формами.
γ-Гидроксикарбонильные соединения образуют производные тетрагидрофурана.
δ-Гидроксикарбонильные соединения образуют цикл тетрагидропирана, точнее производные 2-гидрокситетрагидропирана, в которых появляется асимметрический атом углерода.

Это реакции внутримолекулярного нуклеофильного присоединения с кислотным катализом.

Гидролиз этих соединений протекать не может, так как в процессе реакции не образовывалось воды (вода не отщеплялась).
8.Напишите схемы реакций получения:
- полного этилового эфира бутандиовой кислоты из бутандиовой кислоты
- полного амида бутандиовой кислоты из полного метилового эфира той же кислоты
- метилацетата из соответствующей карбоновой кислоты и ангидрида
- ацетамида из соответствующих функциональных производных: сложного эфира и ангидрида
- метилацетата по реакции этерификации
- сложного эфира из бутановой кислоты и этилового спирта
- пропанамида из различных ацилирующих агентов: кислоты, ангидрида, сложного эфира
- ангидридов бутановой и бутандиовой кислот из соответствующих кислот
Опишите механизмы реакций. Объясните необходимость катализатора в реакции этерификации.
Решение
studfiles.net