Содержание
Ионизация воды
23 июня, 2020
Ионизация воды
Как известно, химическая формула воды h3O. Однако, несмотря на одинаковую формулу вода может обладать совершенно различными химическими и физическими свойствами. Например, дождевая вода значительно отличается от морской или минеральной воды.
Электролиз
Один из способов, позволяющий изменять свойства воды – это электролиз. После электролиза полученная вода называется ионизированной. Она приобретает уникальные свойства, которые максимально соответствуют внутренней среде организма человека и могут существенно улучшить жизненные процессы.
Ионизация воды, используемая в медико-биологических целях, направлена главным образом на дробление крупных молекулярных кластеров воды для насыщения её мономолекулами и активными ионами. В ходе регулируемого с помощью различных способов, систем и устройств процесса активации-ионизации исследуемого объема воды, в нем изменяются химический состав, физические свойства и внутренняя структура. В ионизированной воде снижаются поверхностное натяжение и электропроводность, а также концентрации растворенного кислорода и азота. Одновременно возрастает концентрация ионов водорода и свободных гидроксильных групп.
В ионизированной воде снижаются поверхностное натяжение и электропроводность, а также концентрации растворенного кислорода и азота. Одновременно возрастает концентрация ионов водорода и свободных гидроксильных групп.
Вода с измельченными кластерами и насыщенная активными ионами обладает более высокими реактивными и растворяющими свойствами, лучше проникает через биологические мембраны, быстрее выводит из организма отходы его жизнедеятельности. Кластер активированной воды содержит в среднем 5-6 молекул (обычной воды 13-16 молекул). Более активная по биофизическим и биохимическим показателям ионизированная вода оптимизирует все обменные процессы в организме, что в конечном итоге способствует продлению срока его нормального функционирования, т.е. увеличению продолжительности здоровой жизни. При употреблении предварительно подготовленной ионизированной воды снижается количество нерационально расходуемой организмом внутренней энергии на доведение физико-химических параметров обычной крупнокластерной воды до значений оптимальных для ее усвоения и расходования организмом. Сэкономленное путем внешней водоподготовки количество внутриорганизменной энергии используется на интенсификацию обменых процессов в клеточных структурах и на поддержание нормальной работы всех систем и органов человека. Следовательно, ионизированная вода при ее сбалансированном использовании для питья — мощный энергетический регулятор жизнеобеспечивающих обменных процессов в организме.
Сэкономленное путем внешней водоподготовки количество внутриорганизменной энергии используется на интенсификацию обменых процессов в клеточных структурах и на поддержание нормальной работы всех систем и органов человека. Следовательно, ионизированная вода при ее сбалансированном использовании для питья — мощный энергетический регулятор жизнеобеспечивающих обменных процессов в организме.
«Живая вода»
Исследованиями установлено, что наиболее полезная для здоровья ионизированная вода или, так называемая «живая вода», известная в мире под названием «Alkaline Water»( щёлочная вода -англ.). Она имеет выраженную щёлочную реакцию, существенно отрицательное значение окислительно-восстановительного потенциала (ОВП). Несомненная польза ионизированной щёлочной воды проявляется в нейтрализации нарастающей кислотной нагрузки на организм — бича жителей крупных и средних городов. Загрязнённая среда, неправильное питание, преобладание в рационе кислых продуктов, недостаточное потребление чистой воды и другие факторы приводят к закислению организма. В кислой среде ухудшается перенос кислорода к органам и тканям, организм плохо усваивает необходимые ему минеральные вещества. Когда в организме скапливается большое количество кислоты и нарушаются механизмы ее вывода организм подвергается сильнейшей интоксикации. Высокая кислотность вызывает сбои в работе важнейших систем организма, в том числе иммунной и человек становится беззащитным перед болезнями.
В кислой среде ухудшается перенос кислорода к органам и тканям, организм плохо усваивает необходимые ему минеральные вещества. Когда в организме скапливается большое количество кислоты и нарушаются механизмы ее вывода организм подвергается сильнейшей интоксикации. Высокая кислотность вызывает сбои в работе важнейших систем организма, в том числе иммунной и человек становится беззащитным перед болезнями.
Активированная электролизом ионизированная вода, обладая высокой текучестью и растворяющей способностью, эффективно заменяет и дополняет собой большинство очищающих пищевых добавок и физиотерапевтических процедур. Поэтому может использоваться для комплексной очистки организма: нейтрализации и выведения шлаков, токсинов, канцерогенов и радионуклидов.
Многие ученые-медики, использовавшие ионизированную воду на практике указывали, что она увеличивает продолжительность жизни клеток человека в искусственно созданных неблагоприятных условиях в 10-15 раз. Также ускоряет регенерацию здоровых клеток. При диагностике по методу доктора Фолля, всего один глоток этой воды воздействует на уровень энергетики организма аналогично тщательно подобранному гомеопатическому комплексу. Снижает утомляемость у водителей, пользователей компьютеров, у владельцев мощных радиотелефонов. Полностью снимает «синдром утренней усталости», токсикоз при беременности. Многократно увеличивает вероятность появления здорового потомства у людей, проживающих в экологически неблагоприятных зонах. Значительно увеличивает эффективность воздействия физиотерапевтических приборов и физиотерапевтических процедур. Усиливает усвояемость витаминно-минеральных комплексов, чтоо позволяет сократить время достижения положительного эффекта, уменьшить дозировки препаратов на 20-50%. Значительно улучшает самочувствие при гриппе и ОРЗ, резко снижает вероятность осложнений.
При диагностике по методу доктора Фолля, всего один глоток этой воды воздействует на уровень энергетики организма аналогично тщательно подобранному гомеопатическому комплексу. Снижает утомляемость у водителей, пользователей компьютеров, у владельцев мощных радиотелефонов. Полностью снимает «синдром утренней усталости», токсикоз при беременности. Многократно увеличивает вероятность появления здорового потомства у людей, проживающих в экологически неблагоприятных зонах. Значительно увеличивает эффективность воздействия физиотерапевтических приборов и физиотерапевтических процедур. Усиливает усвояемость витаминно-минеральных комплексов, чтоо позволяет сократить время достижения положительного эффекта, уменьшить дозировки препаратов на 20-50%. Значительно улучшает самочувствие при гриппе и ОРЗ, резко снижает вероятность осложнений.
ПРЯМЫЕ ЭНЕРГОЗАТРАТЫ НА ЭЛЕКТРОЛИЗ ВОДЫ Тем не менее, смесь водорода и кислорода, получаемая из воды, широко используется в газосварочных аппаратах, а на Тайване уже выпускаются бытовые газовые плиты, в которых природный газ заменён кислородно-водородной смесью. Из неё следует, что все электролизёры, заряжаясь в начале работы, приобретают постоянный потенциал , свойственный конденсатору или аккумулятору. Величина этого потенциала увеличивается с увеличением количества ячеек в электролизёре. Рис. 1. Осциллограммы напряжения (1) и тока (2) на клеммах электролизёра На рис. 1 хорошо видно, что импульсы напряжения 1 восстанавливают средний потенциал электролизера, который уменьшается при отсутствии импульса, а импульс тока 2 почти не изменяет его среднюю величину . Из этого следует, что процесс электролиза воды при отсутствии импульса напряжения не прекращается. Современные учебники и научная литература по импульсной технике рекомендуют определять средние величины напряжения и тока путём деления их амплитудных значений и на скважность импульсов . Из осциллограммы (рис. 1) следует: ; (1) . (2) . (4) На рис. 3. представлена осциллограмма напряжения и тока, снятая с клемм электромеханического генератора электрических импульсов (рис. 2) и электролизёра. Обработка этой осциллограммы показала, что скважность импульсов напряжения равна, примерно, , а тока — . Средние величины напряжения и тока определяются делением их амплитудных значений , на скважность импульсов (1), (2). Осциллограмма даёт нам такие значения: , . С учётом этого средняя мощность равна Рис. 2. Электромеханический генератор электрических импульсов Рис. генератора электрических импульсов и электролизёра Разность мощности между рабочим и холостым ходом, зафиксированная счётчиком электроэнергии на клеммах электродвигателя, равна 42 Ватта. Эта величина — в промежутке между результатами расчётов по формулам (3) и (4). Что надо учесть ещё, чтобы приблизить теоретические значения (5) и (6) к экспериментальной величине 42 Ватта? Обмотка и корпус генератора нагреваются, а осциллограмма (рис. 3) не учитывает расход энергии на этот процесс. Масса генератора 1600 г. Средняя разность температуры генератора, между рабочим и холостым ходами с учётом охлаждения поверхности вращающегося ротора, составила 13 град. Генератор изготовлен из стали, его удельная теплоёмкость равна 0,50 Дж/грамм. град. Опыт длился 560 сек. За это время затраты энергии на нагрев статора и ротора электромеханического генератора электрических импульсов составили 0,5х1600х13=10400 Дж или 10400/560=18,57 Ватт. Уточнение температуры нагрева всех частей генератора усиливает связь математической модели (3) для расчёта импульсной мощности с реальностью (42 Ватта) и удаляет математическую модель (4) от этой реальности (42 Ватта). Таким образом, прямые удельные затраты мощности на электролиз воды составляют 18,63 Ватта. Потери энергии на нагрев генератора (42,00-18,63=23,37 Ватта) больше прямых затрат. За час работы было получено 11,10 литра газовой смеси. Прямые удельные затраты энергии на её получение составили 18,63Втч/11,10=1,68 Втч/литр. Если взять затраты энергии на получение смеси газов из воды лучшими современными электролизёрами за 100%, то КПД процесса электролиза воды этими электролизёрами будет около 56,60%. Это свидетельствует о том, что почти все резервы уменьшения затрат энергии на традиционный процесс электролиза воды и на традиционный способ питания электролизёров уже почти исчерпаны и нужно искать другие решения этих проблем. Низковольтный процесс электролиза воды известен со времен Фарадея. Он широко используется в современной промышленности. В соответствии с законом Фарадея, затраты энергии на получение одного кубического метра водорода в этом случае составляют около 4 кВтч/. Между тем в Природе существует более экономный процесс разложения молекул воды на водород и кислород. Протекает он при фотосинтезе. При этом атомы водорода отделяются от молекул воды и используются в качестве соединительных звеньев при формировании органических молекул, а кислород уходит в атмосферу. Возникает вопрос: а нельзя ли смоделировать электролитический процесс разложения воды на водород и кислород, который идет при фотосинтезе? Поиск условий моделирования процесса разложения воды на водород и кислород, который идет при фотосинтезе, привел к простой конструкции ячейки (рис. Прежде всего, отметим, что материал анода и катода один – сталь, что исключает возможность формирования гальванического элемента. Тем не менее, на электродах ячейки появляется разность потенциалов около 0,1В при полном отсутствии электролитического раствора в ней. После заливки раствора разность потенциалов увеличивается. При этом положительный знак заряда всегда появляется на верхнем электроде, а отрицательный – на нижнем. Если источник питания генерирует импульсы напряжения, то выход газов увеличивается. Процесс генерирования газов легко наблюдается по выходу образующихся пузырьков. Они продолжают выделяться и после отключения электролизера от сети. Конечно, после отключения электролизера от сети интенсивность выхода газов постепенно уменьшается, но не прекращается в течение нескольких часов. Это убедительно доказывает тот факт, что электролиз идет за счет разности потенциалов на электродах (рис. Рис. 4. Низкоамперный электролизер (Пат. № 2227817) Рис. 5. Напряжение и ток на клеммах включённого в сеть электролизёра (рис. 4) Известно, что грамм-атом численно равен атомной массе вещества, а грамм-молекула – молекулярной массе вещества. Например, грамм-молекула водорода в молекуле воды равна двум граммам, а грамм-атом атома кислорода – 16 граммам. Грамм-молекула воды равна 18 граммам. Так как масса водорода в молекуле воды составляет 2х100/18=11,11%, а масса кислорода – 16х100/18=88,89%, то это же соотношение водорода и кислорода содержится в одном литре воды. Один литр водорода весит 0,0846 гр., а один литр кислорода -1,47 гр. Это означает, что из одного литра воды можно получить 111,11/0,0846=1313,36 литра водорода и 888,89/1,47=604,69 литра кислорода. Из этого также следует, что один грамм воды содержит 1,31 литра водорода и 0,60 литра кислорода. Затраты электроэнергии на получение 1000 литров водорода сейчас составляют 4 кВтч, а на один литр – 4 Втч. Поскольку из одного грамма воды можно получить 1,31 литра водорода, то на получение водорода из одного грамма воды сейчас расходуется 1,31х4=5,25 Втч. В табл. 1 представлены результаты эксперимента при питании электролизера импульсами напряжения и тока (рис. 5) с периодическим включением его в электрическую сеть на 10 минут. Остальные 50 минут каждого часа электролизёр работал при отключенной электрической сети, а процесс выхода газов продолжался.
Таким образом, есть основания полагать, что низкоамперный электролизёр обладает свойствами конденсатора или аккумулятора. Зарядившись в начале, он постепенно разряжается под действием электролитических процессов, протекающих в нём. Если его подзаряжать периодически импульсами напряжения, то заряд электролизёра, как конденсатора, будет оставаться постоянным, а процесс электролиза — стабильным. Наличие постоянной составляющей электрического потенциала на входе в электролизёр показывает, что для расчета затрат энергии на процесс электролиза надо использовать не показания вольтметра, а показания осциллографа, регистрирующие полный импульсный потенциал подзарядки электролизёра, следующий из осциллограммы, представленной на рис. 5. Вполне естественно, что указанный эффект реализуется лишь при использовании электромеханического источника питания. Таким образом, вольтметр показывает величину напряжения заряженного электролизёра, как конденсатора, который постепенно разряжается, а полные импульсы напряжения, фиксируемые осциллографом – величину его подзарядки, которая и характеризует прямую энергию на электролиз воды. Затраты энергии на получение водорода из воды при низкоамперном электролизе значительно уменьшаются, если в качестве источника энергии использовать электромеханический генератор электрических импульсов. Обоснование параметров такого генератора – непростая задача. ЗАКЛЮЧЕНИЕ ЛИТЕРАТУРА
http://kubsau.ru/science/prof.php?kanarev
http://kubsau.ru/science/prof.php?kanarev Папка «Видеофильм». Каталог: files жүктеу/скачать 454.5 Kb. Достарыңызбен бөлісу: |
Электролиз воды | Энергетические основы для химии в старших классах
- Обзор для учителя
- Подготовка
- Демонстрация
- Обсуждение со студентами
- Пояснение
- Расширения
Краткий обзор учителя
Резюме
В этой демонстрации учащиеся исследуют идею о том, что энергию батареи можно использовать для запуска химической реакции, которая не происходит самопроизвольно, например, расщепление молекул воды с образованием газообразного водорода и кислорода.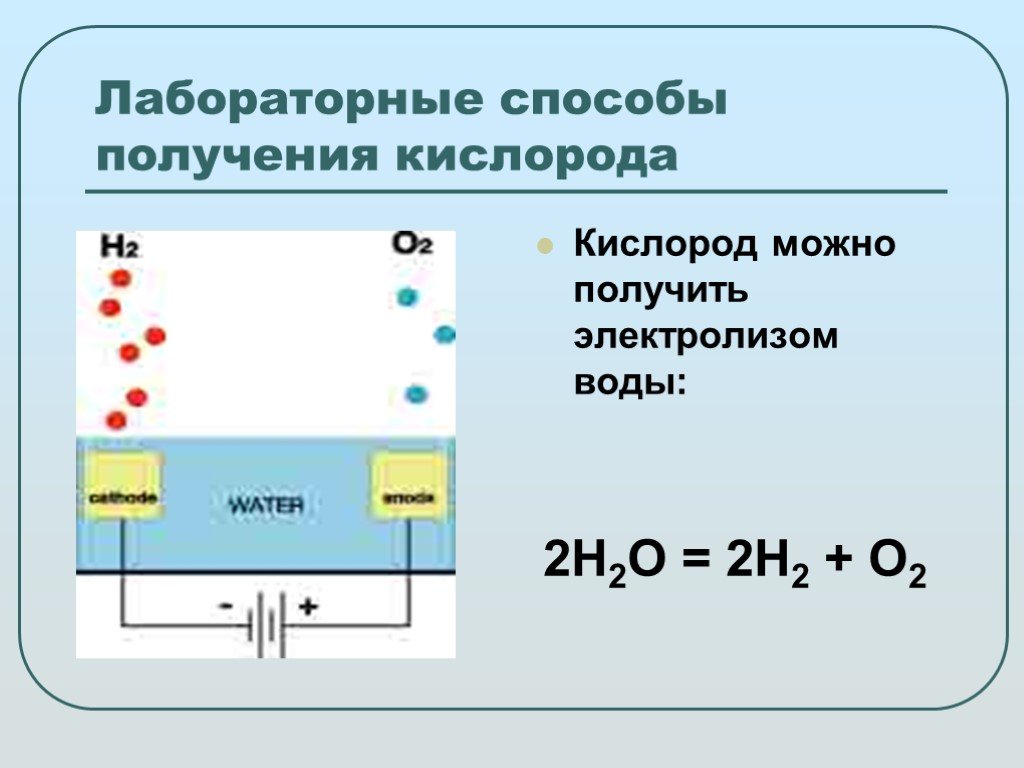
Задача
Учащиеся узнают об использовании внешнего источника энергии для запуска химической реакции.
Безопасность
Убедитесь, что вы и учащиеся носите подходящие защитные очки.
Материалы
- 9-вольтовая батарея
- Две металлические кнопки
- Вода
- Английская соль (MgSO 4 • 7 H 2 O)
- Чистая, пустая, прозрачная и бесцветная пластиковая бутылка для воды с крышкой и удаленной этикеткой
- Ножницы
- Черный перманентный маркер
- Химический стакан или пластиковая чашка
- Бумажные полотенца или глина для лепки
Необходимое время
Часть одного урока, примерно 10–15 минут.
Демонстрационные советы
Соль Эпсома можно приобрести в местных аптеках, где она продается как слабительное и как средство для добавления в ванну с теплой водой для лечения боли. Можно использовать пластиковые контейнеры, отличные от бутылки с водой, если у контейнера плоское дно для легкого подключения к контактам батареи, а пластик достаточно тонкий, чтобы легко проталкивать кнопки. Например, можно использовать маленькие пластиковые стаканчики для приправ.
Например, можно использовать маленькие пластиковые стаканчики для приправ.
Включение в учебную программу
Эта демонстрация может быть включена в раздел по химическим реакциям или термохимии.
Процедура для учителя
Подготовка
- Снимите крышку с чистой, пустой, прозрачной и бесцветной пластиковой бутылки для воды. Переверните крышку так, чтобы верхняя часть крышки касалась двух контактов 9-вольтовой батареи. Отцентрируйте крышку над двумя контактами. Используя черный перманентный маркер, сделайте две точки на внутренней стороне крышки, по одной над центром каждого контакта.
- Поместите крышку на твердую поверхность верхней частью крышки вверх. Вставьте металлическую кнопку в верхнюю часть крышки прямо над одной из точек. Вставьте вторую кнопку в крышку прямо над второй точкой. Две кнопки не должны соприкасаться.
- С помощью ножниц отрежьте верхнюю половину бутылки, чтобы она выглядела как воронка.
 Закрутите крышку обратно на бутылку.
Закрутите крышку обратно на бутылку.
Демонстрация
- Покажите учащимся верхнюю половину бутылки, особенно две металлические кнопки, продетые через крышку.
- Наполните нижнюю часть разрезанной бутылки водой примерно наполовину. Добавьте примерно чайную ложку английской соли. Помешивать, пока большая часть соли не растворится.
- Налейте раствор английской соли в верхнюю часть бутылки (держите ее крышкой вниз).
- Попросите студента-добровольца понаблюдать за решением, особенно за двумя точками металлических кнопок. Есть ли признаки реакции?
- Поместите две металлические кнопки так, чтобы каждая кнопка касалась одного из контактов на 9-вольтовая батарея. Попросите добровольца еще раз понаблюдать за раствором. Есть ли признаки реакции?
- Батарейку можно поместить на дно стакана или прозрачного бесцветного пластикового стакана, удерживая вертикально с помощью бумажных полотенец или глины для лепки.
 Затем верхнюю часть бутылки можно поставить на батарею с большей устойчивостью, если инструктор хочет показать ее поближе к остальной части класса.
Затем верхнюю часть бутылки можно поставить на батарею с большей устойчивостью, если инструктор хочет показать ее поближе к остальной части класса.
Обсуждение со студентами
- Какие существуют доказательства того, что реакция происходит, когда контакты батареи касаются металлических кнопок?
Пузырьки одного или нескольких газов образуются и поднимаются из каждой кнопки.
- Есть ли разница в количестве газа, образующегося при каждом контакте батареи?
Да, на одном из соединений образуется больше пузырьков.
- Может ли разница, описанная в вопросе 2, быть связана с разницей в гвоздях? Что можно сделать с аппаратом, чтобы потенциально подтвердить идею о том, что контакт батареи ответственен за 9?0141 .
Можно повернуть контакты батареи так, чтобы каждый контакт касался противоположной кнопки. Контакт батареи, который произвел больше пузырьков в первый раз, должен по-прежнему производить больше пузырьков при прикосновении к любой кнопке.

- Для чего нужен аккумулятор?
Батарея запускает реакцию, которую мы не наблюдали самопроизвольно без этого дополнительного внешнего источника энергии.
- Зачем в воду добавляют английскую соль?
Английская соль является электролитом и служит для проведения электричества через раствор. Электричество от батареи может проходить через раствор и между двумя кнопками.
6. Каково сбалансированное уравнение распада молекул воды?
7. Если наблюдаемая нами реакция представляет собой расщепление молекул воды, какой газ может выделяться при контакте батареи и почему?
В результате реакции распада молекул воды образуются два газа: H 2 и O 2 . В уравнении получается в два раза больше газообразного водорода, чем газообразного кислорода. Контакт батареи, который производит больше пузырьков, будет производить газообразный водород.
8. Что можно сделать, чтобы собрать дополнительные доказательства того, что образуются два газа и что это H 2 и O 2 ?
Что можно сделать, чтобы собрать дополнительные доказательства того, что образуются два газа и что это H 2 и O 2 ?
Можно собирать образующиеся газы и проверять их на известные свойства H 2 и О 2 газы.
Пояснение
Разделение слова «электролиз» на составные части обобщает его значение — использование электричества (электро-) для разрушения (-лиза) чего-либо. В этой демонстрации электричество, подаваемое 9-вольтовой батареей, используется для расщепления молекул воды, в результате чего образуются газообразные водород и кислород.
Идея включения энергии в качестве реагента или продукта в химическое уравнение может быть использована для иллюстрации потребности в дополнительной внешней силе энергии для управления реакцией, которая обычно происходит
не происходит самопроизвольно и связать демонстрацию с представлениями об экзотермических и
эндотермических реакциях.
Например, Химия в Сообществе описывает:
…если конкретная химическая реакция является экзотермической (с выделением тепловой энергии), то обратная реакция является эндотермической (преобразование тепловой энергии в потенциальную). Например, сжигание газообразного водорода с образованием воды является экзотермическим процессом. Энергия, выделяемая при образовании связей H–O в молекулах воды, больше, чем необходимая для разрыва связей в молекулах h3 и O2:
Следовательно, разделение воды на элементы — обратная реакция — должна быть эндотермической, количество энергии равно количеству выделяющейся при образовании воды из газообразных Н 2 и О 2 .
Удлинители
Предложите учащимся разработать метод сбора газов для демонстрации и описать, как их можно проверить, чтобы определить, являются ли они h3 и O2, и какие из них являются какими. Стеклянные трубки, наполненные раствором английской соли, можно перевернуть над двумя кнопками для сбора газов; сбор заметного количества газа может занять значительное время.
Демонстрация обратной реакции, реакции смешивания газообразных водорода и кислорода и их сжигания, может быть использована в связи с этой демонстрацией электролиза. Эту взрывоопасную экзотермическую реакцию следует использовать с соответствующими мерами предосторожности и оборудованием.
Другая распространенная установка, используемая для демонстрации электролиза воды, использует два графитовых карандаша, заостренных с обоих концов, в качестве электродов.
Инструкции, написанные для учащихся по проведению этого исследования, доступны бесплатно в учебной программе «Химия для средней школы» Американского химического общества.
Вернуться к началу
Тайна, искусство и наука о воде: химия воды: электролиз
Водород + Кислород = Вода
 Беглый взгляд на химическое уравнение образования воды говорит нам больше.
Беглый взгляд на химическое уравнение образования воды говорит нам больше.2h3 + O2 = 2h3O
Две молекулы двухатомного водорода смешиваются с одной молекулой двухатомного кислорода, чтобы получить две молекулы воды. Другими словами, отношение водорода к кислороду равно 2:1, отношение водорода к воде равно 1:1, а отношение кислорода к воде равно 1:2.
Есть что-то еще, хотя это не отображается в уравнении. Энергия. Образование воды из ее элементов производит, помимо воды, огромное количество энергии, а именно 572 кДж.
2h3 + O2 = 2h3O + ЭНЕРГИЯ
Это пример экзотермической реакции, реакции, при которой выделяется энергия. Это также пример того, что называется реакцией горения, когда вещество (в данном случае газообразный водород) соединяется с кислородом. Вы, вероятно, знакомы с этой реакцией благодаря двум трагическим примерам высвобождения энергии при реакции горения водорода, «Гинденбургу» и космическому челноку «Челленджер».
Водородное топливо?
Да, водород — хорошее, чистое топливо, побочным продуктом которого является только вода. К сожалению, он производит так много энергии, что может выйти из-под контроля, что приведет к взрыву.
Но давайте на минуту забудем об этой взрывоопасной части и подумаем о возможностях — водород как новое чистое топливо — это может положить конец энергетическому кризису — но
где взять водород?
Можем ли мы создать водород из воды?
О да! Это та же химическая реакция, но в обратном порядке:
2h3O + ЭНЕРГИЯ = 2h3 + O2
Заметьте теперь, что требуется, чтобы энергия ДОБАВЛЯЛАСЬ К реагентам. Это пример эндотермической реакции. Это означает, что мы могли бы использовать воду в качестве топлива! ЕСЛИ (и это большое «если») мы могли бы найти простой способ превратить воду в водород и кислород, то водород можно было бы использовать в качестве чистого топлива.
Одним из способов преобразования воды в водород и кислород является процесс электролиза — использование электричества в качестве источника энергии для запуска реакции. Давайте посмотрим, как это может выглядеть:
Давайте посмотрим, как это может выглядеть:
ИСТОЧНИК ИЗОБРАЖЕНИЯ: «Химия в контексте» Wm C Brown Publishers, Dubuque Iowa, 2-е издание, проект Американского химического общества, изд.: А. Трумэн Шварц и др., 1997, глава 5 «Чудо воды»
Разве это не довольно круглая форма?
Использование Энергии для разбивания воды с образованием водорода для объединения кислорода с образованием Энергии – таким образом, это довольно замкнутый круг. На самом деле, из-за законов термодинамики вы не можете безубыточности в этом обмене энергией. Однако существуют более эффективные способы разложения воды, а именно использование КАТАЛИЗА.
ИСТОЧНИК ИЗОБРАЖЕНИЯ: «Химия в контексте» Wm C Brown Publishers, Dubuque Iowa, 2-е издание, проект Американского химического общества, изд.: А. Трумэн Шварц и др., 1997, глава 5 «Чудо воды»
Что делает катализатор?
Катализатор — это химическое соединение, которое ускоряет реакцию, но само в процессе не изменяется. Следовательно, катализатор в конце реакции может снова действовать, чтобы помочь другому реагенту пройти через реакцию.
Следовательно, катализатор в конце реакции может снова действовать, чтобы помочь другому реагенту пройти через реакцию.
Катализаторы работают за счет снижения энергетического барьера между реагентами и продуктами.
В данном случае:
2h3O + ЭНЕРГИЯ = 2h3 + O2
там, где обычно требуется огромное количество энергии для превращения реагентов в продукты — добавление катализатора может уменьшить количество требуемой энергии и, следовательно, ускорить реакцию!
2h3O + КАТАЛИЗАТОР+ энергия = 2h3 + O2 + КАТАЛИЗАТОР
Действительно ли существует этот катализатор?
Что-то вроде… Вы когда-нибудь задумывались, как растение использует воду и углекислый газ для создания глюкозы и кислорода? Это тоже эндотермическая реакция, реакция с выделением энергии, протекающая в обратном направлении. Обычно мы думали бы об использовании глюкозы в качестве топлива, путем окисления мы могли бы производить углекислый газ, воду и энергию.
 На самом деле это то, что НАШИ тела делают, чтобы обеспечить нас энергией, необходимой для поддержания всех наших функций организма, включая МЫШЛЕНИЕ!
На самом деле это то, что НАШИ тела делают, чтобы обеспечить нас энергией, необходимой для поддержания всех наших функций организма, включая МЫШЛЕНИЕ!Глюкоза (C6h22O6) + Кислород (O2) = Вода (h30) + Углекислый газ (CO2) + ЭНЕРГИЯ
Чтобы запустить реакцию в обратном направлении, растение использует катализатор — ХЛОРОФИЛЛ — и энергию СОЛНЦА, чтобы способствовать разложению воды. В то время как хлорофильная реакция действительно производит двухатомный кислород, она не производит водород в газообразной форме. Водород, выделяющийся из воды, используется для образования глюкозы.
Можем ли мы использовать такой катализатор для преобразования воды и солнечного света в топливо?
Ученые часто используют природу в качестве модели для разработки новых соединений. Одной из таких разработок, которая широко изучалась в этом отношении, является молекула, известная как Rubippy. Структура Rubippy показана ниже. Он похож по строению на молекулу хлорофилла, имеющую металлический центр (в хлорофилле это ион магния, в рубине — ион рутения) и присоединенную систему органических колец (в хлорофилле — производное порфирина, в рубине — производное пиридина).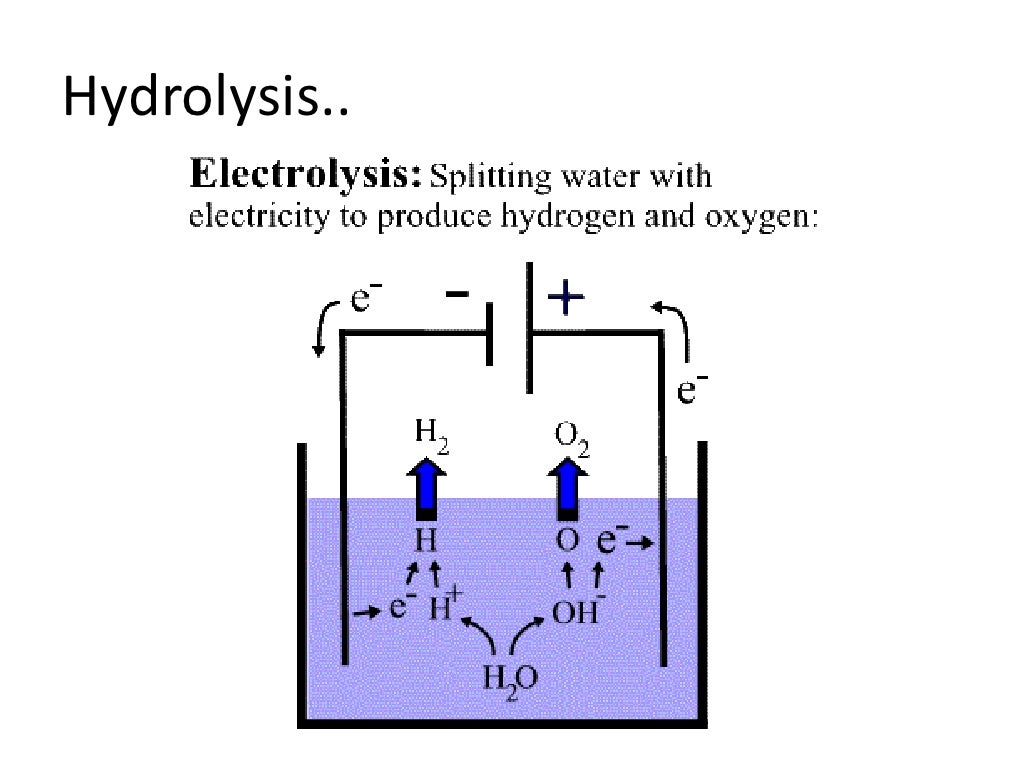 .
.
ИСТОЧНИК ИЗОБРАЖЕНИЯ: «Химия в контексте» Wm C Brown Publishers, Dubuque Iowa, 2-е издание, проект Американского химического общества, изд.: А. Трумэн Шварц и др., 1997, глава 5 «Чудо воды»
Действуя как «ретрансляционный» канал для передачи электронов, Rubippy продемонстрировал некоторый потенциал именно в этом — превращать воду и солнечный свет в чистый, казалось бы, неиссякаемый источник энергии. Однако, несмотря на то, что rubippy показала себя многообещающей в этом отношении, она не является коммерчески жизнеспособным предприятием из-за своей высокой стоимости, нестабильности и низкой эффективности.
Если бы ученым удалось заставить Рубиппи работать или создать жизнеспособную альтернативу, что бы мы сделали с потенциалом взрыва при использовании водородного топлива?
Хороший вопрос! Поверите ли вы, что возможно сжечь водород, не позволяя кислороду и водороду соприкасаться? Это может произойти в ТОПЛИВНОМ ЭЛЕМЕНТЕ.


 М. Канарёв kanpyil@mail.ru
М. Канарёв kanpyil@mail.ru Пока затраты на получение этой смеси превышают стоимость природного газа, но это не останавливает исследователей и они настойчиво ищут пути снижения этих затрат. Конечно, если бы исследователи знали прямые затраты энергии на электролиз воды, то они уже давно бы достигли намеченной цели. Как же измерить прямые затраты энергии на электролиз воды? Поиск ответа на этот вопрос начнём с анализа осциллограммы (рис. 1).
Пока затраты на получение этой смеси превышают стоимость природного газа, но это не останавливает исследователей и они настойчиво ищут пути снижения этих затрат. Конечно, если бы исследователи знали прямые затраты энергии на электролиз воды, то они уже давно бы достигли намеченной цели. Как же измерить прямые затраты энергии на электролиз воды? Поиск ответа на этот вопрос начнём с анализа осциллограммы (рис. 1). Это значит, что нет нужды подавать напряжение в электролизёр непрерывно, так как он имеет свой потенциал , для поддержания заданной величины которого достаточна периодическая подзарядка электролизёра. Чему же будет равна мощность на клеммах электролизёра при импульсном её потреблении?
Это значит, что нет нужды подавать напряжение в электролизёр непрерывно, так как он имеет свой потенциал , для поддержания заданной величины которого достаточна периодическая подзарядка электролизёра. Чему же будет равна мощность на клеммах электролизёра при импульсном её потреблении? Попытаемся раскрыть причину этого противоречия. Для этого изготовим автономный источник питания, который не был бы связан ни с аккумулятором, ни с общей электрической сетью. Главное требование к такому источнику – одинаковость импульсов напряжения и тока на его клеммах и на клеммах электролизёра. Роль такого источника может выполнить электромеханический генератор электрических импульсов (рис. 2). Он приводится во вращение электродвигателем, включённым в электрическую сеть. Вполне естественно, что электрические цепи электродвигателя и электромеханического генератора электрических импульсов изолированы друг от друга. В этом случае можно проследить за изменением баланса мощности на клеммах электродвигателя, электромеханического генератора электрических импульсов и электролизёра и проверить какая из формул (3) или (4) отражает реальность.
Попытаемся раскрыть причину этого противоречия. Для этого изготовим автономный источник питания, который не был бы связан ни с аккумулятором, ни с общей электрической сетью. Главное требование к такому источнику – одинаковость импульсов напряжения и тока на его клеммах и на клеммах электролизёра. Роль такого источника может выполнить электромеханический генератор электрических импульсов (рис. 2). Он приводится во вращение электродвигателем, включённым в электрическую сеть. Вполне естественно, что электрические цепи электродвигателя и электромеханического генератора электрических импульсов изолированы друг от друга. В этом случае можно проследить за изменением баланса мощности на клеммах электродвигателя, электромеханического генератора электрических импульсов и электролизёра и проверить какая из формул (3) или (4) отражает реальность. Поскольку между их клеммами лишь провода, то осциллограмма напряжения и тока у них едина.
Поскольку между их клеммами лишь провода, то осциллограмма напряжения и тока у них едина. 3. Осциллограмма напряжения (1) и тока (2) на клеммах электромеханического
3. Осциллограмма напряжения (1) и тока (2) на клеммах электромеханического Это значит, что к величинам мощности (5) и (6), рассчитанным по формулам (3) и (4), надо прибавить по 18,57 Ватт. В результате будем иметь 37,20 Ватта и 76,44 Ватта соответственно.
Это значит, что к величинам мощности (5) и (6), рассчитанным по формулам (3) и (4), надо прибавить по 18,57 Ватт. В результате будем иметь 37,20 Ватта и 76,44 Ватта соответственно. Они однозначно следуют из осциллограммы (рис. 3), но мы не будем детализировать их, а приведём результаты экспериментов по низкоамперному электролизу воды.
Они однозначно следуют из осциллограммы (рис. 3), но мы не будем детализировать их, а приведём результаты экспериментов по низкоамперному электролизу воды. 4). Оказалось, что процесс электролиза может протекать при среднем токе 0,02 А. Поэтому этот процесс назван низкоамперным.
4). Оказалось, что процесс электролиза может протекать при среднем токе 0,02 А. Поэтому этот процесс назван низкоамперным. 4 и 5). Спустя час после отключения электролизёра от сети напряжение на его электродах уменьшается до одного вольта, а постоянная составляющая тока почти не изменяется.
4 и 5). Спустя час после отключения электролизёра от сети напряжение на его электродах уменьшается до одного вольта, а постоянная составляющая тока почти не изменяется. Это означает, что в 1000 граммах воды содержится 111,11 грамм водорода и 888,89 грамм кислорода.
Это означает, что в 1000 граммах воды содержится 111,11 грамм водорода и 888,89 грамм кислорода. 4)
4)


 Дело это будет не быстрое, так как процессы горения природного газа и кислородно-водородной смеси, без взрыва, значительно отличаются.
Дело это будет не быстрое, так как процессы горения природного газа и кислородно-водородной смеси, без взрыва, значительно отличаются. Закрутите крышку обратно на бутылку.
Закрутите крышку обратно на бутылку. Затем верхнюю часть бутылки можно поставить на батарею с большей устойчивостью, если инструктор хочет показать ее поближе к остальной части класса.
Затем верхнюю часть бутылки можно поставить на батарею с большей устойчивостью, если инструктор хочет показать ее поближе к остальной части класса.