Диссоциация воды. Водородный показатель. Диссоциации воды
Диссоциация воды. Водородный показатель
Чистая вода плохо проводит электрический ток, но всё же обладает измеримой электропроводностью, которая объясняется частичной диссоциацией молекул Н2О на ионы водорода и гидроксид-ионы:
Н2О Н++ ОН–
Н++ ОН–
По величине электропроводности чистой воды можно вычислить концентрацию в ней ионов Н+и ОН–. При 25оС она равна 10–7моль/л.
Константа диссоциации Н2О рассчитывается следующим образом:
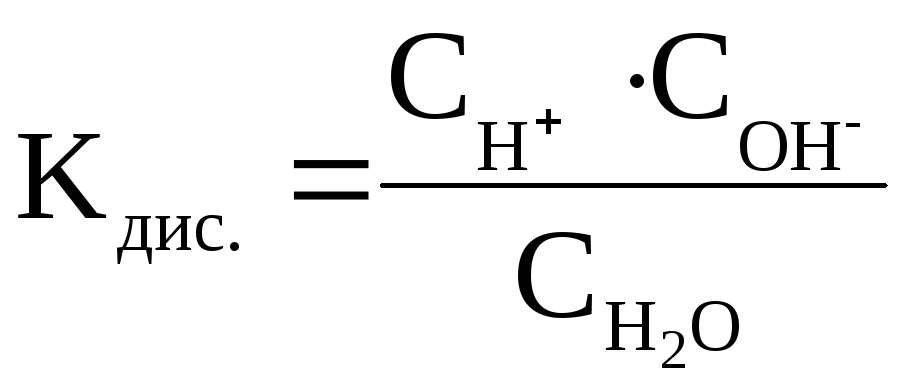
Перепишем это уравнение:
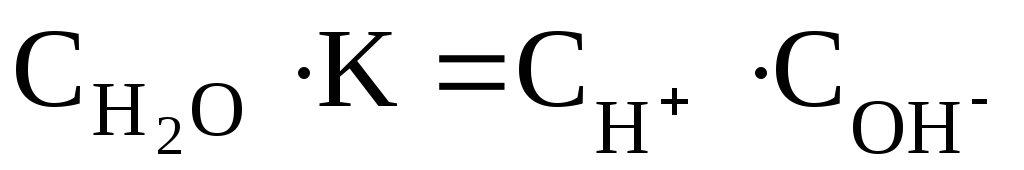
Следует подчеркнуть, что данная формула содержит равновесные концентрации молекул Н2О, ионов Н+и ОН–, которые установились на момент наступления равновесия в реакции диссоциации Н2О.
Но, поскольку степень диссоциации Н2О очень мала, можно считать, что концентрация недиссоциированных молекул Н2О в момент наступления равновесия практически равна общей начальной концентрации воды, т.е. 55,56 моль/дм3(1 дм3Н2О содержит 1000 г Н2О или 1000 : 18 ≈ 55,56 (молей). В разбавленных водных растворах можно считать, что концентрация Н2О будет такой же. Поэтому, заменив в уравнении (42) произведение двух постоянных величин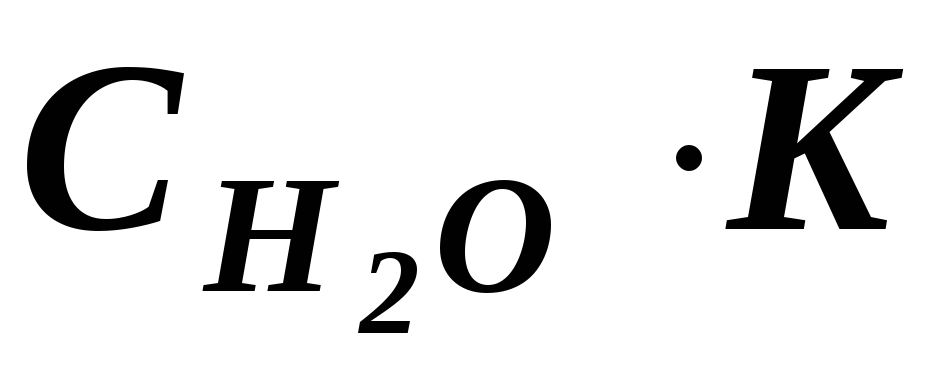 новой константой
новой константой (илиKW), будем иметь:
(илиKW), будем иметь:
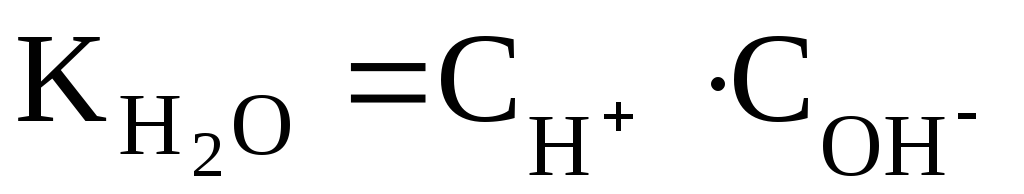
Полученное уравнение показывает, что для воды и разбавленных водных растворов при неизменной температуре произведение молярных концентраций ионов водорода и гидроксид-ионов есть величина постоянная. Она называется иначе ионным произведением воды.
В чистой воде при 25оС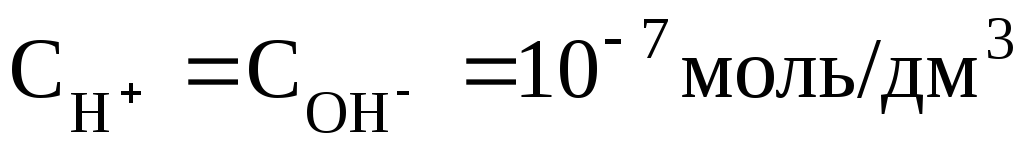 . Поэтому для указанной температуры:
. Поэтому для указанной температуры:
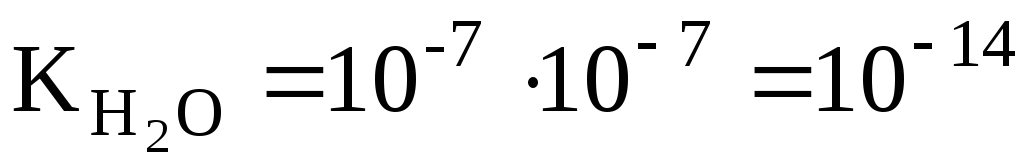
При увеличении температуры значении 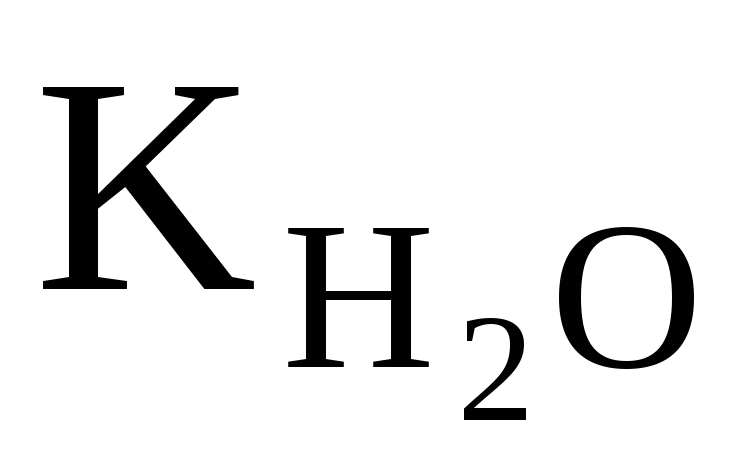 возрастает. При 100оС оно достигает 5,5 ∙ 10–13(рис. 34).
возрастает. При 100оС оно достигает 5,5 ∙ 10–13(рис. 34).
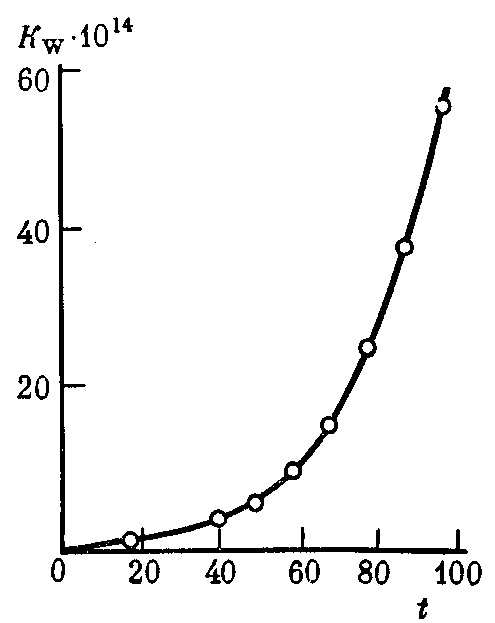
Рис. 34. Зависимость константы диссоциации воды Kw от температурыt (°С)
Растворы, в которых концентрации ионов Н+ и ОН– одинаковы, называются нейтральными растворами. В кислых растворах больше содержится ионов водорода, а в щелочных – гидроксид-ионов.Но какова бы ни была реакция среды в растворе, произведение молярных концентраций ионов Н+и ОН–останется постоянным.
Если, например, к чистой Н2О добавить некоторое количество кислоты и концентрация ионов Н+при этом увеличится до 10-4моль/дм3, то концентрация ионов ОН–, соответственно, понизится так, что произведение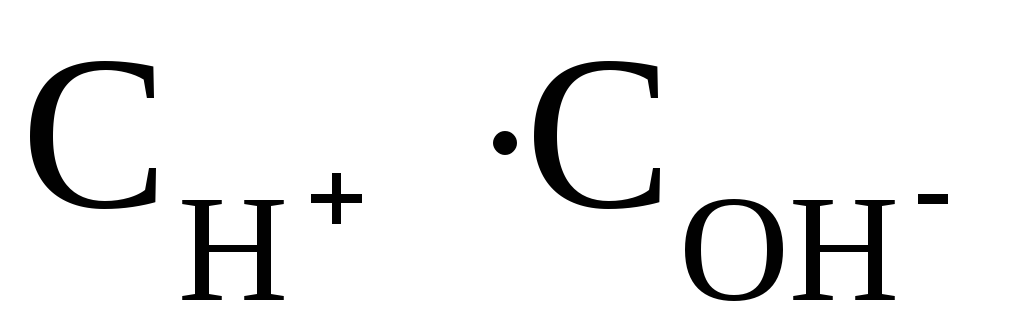 останется равным 10-14. Следовательно, в этом растворе концентрация гидроксид-ионов будет равна 10-14: 10-4= 10-10моль/дм3. Этот пример показывает, что если концентрация ионов водорода в водном растворе известна, то тем самым определена и концентрация гидроксид-ионов. Поэтому реакцию раствора можно количественно охарактеризовать концентрацией ионов Н+:
останется равным 10-14. Следовательно, в этом растворе концентрация гидроксид-ионов будет равна 10-14: 10-4= 10-10моль/дм3. Этот пример показывает, что если концентрация ионов водорода в водном растворе известна, то тем самым определена и концентрация гидроксид-ионов. Поэтому реакцию раствора можно количественно охарактеризовать концентрацией ионов Н+:
нейтральный раствор 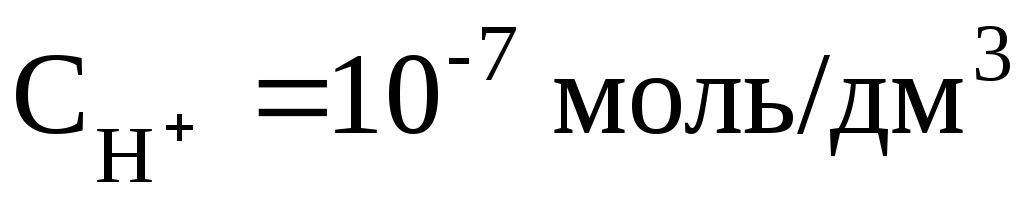
кислый раствор 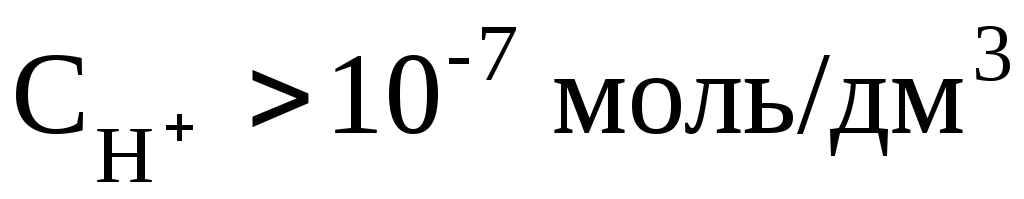
щелочной раствор 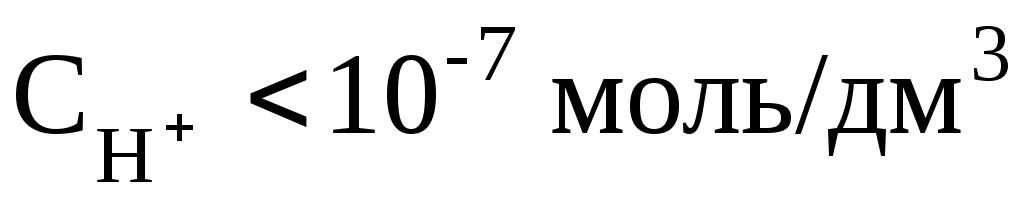
На практике для количественной характеристики кислотности или щёлочности раствора используют не молярную концентрацию в нём ионов Н+, а её отрицательный десятичный логарифм. Эта величина называетсяводородным показателем и обозначается черезрН:
рН = –lg[H+]
Например, если 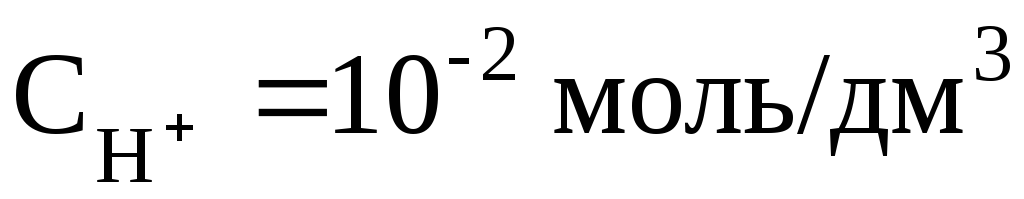 , то рН = 2; если
, то рН = 2; если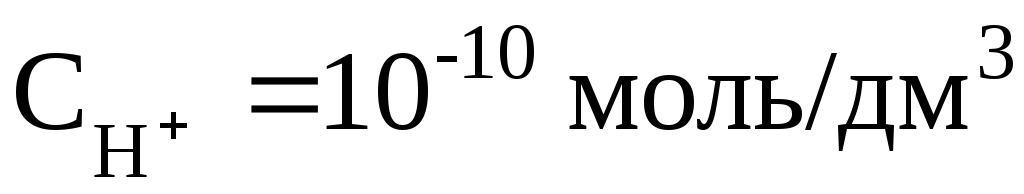 , то рН = 10. В нейтральном растворе рН = 7. В кислых растворах рН < 7 (и тем меньше, чем «кислее» раствор, т.е., чем больше в нём концентрация ионов Н+). В щёлочных растворах рН > 7 (и тем больше, чем «щелочнее» раствор, т.е., чем меньше в нём концентрация ионов Н+).
, то рН = 10. В нейтральном растворе рН = 7. В кислых растворах рН < 7 (и тем меньше, чем «кислее» раствор, т.е., чем больше в нём концентрация ионов Н+). В щёлочных растворах рН > 7 (и тем больше, чем «щелочнее» раствор, т.е., чем меньше в нём концентрация ионов Н+).
Для измерения рН раствора существуют различные методы. Очень удобно приблизительно оценивать реакцию раствора с помощью специальных реактивов, называемых кислотно-основными индикаторами. Окраска этих веществ в растворе меняется в зависимости от концентрации в нём ионов Н+. Характеристика некоторых наиболее распространённых индикаторов представлена в таблице 12.
Таблица 12.Важнейшие кислотно-основные индикаторы
| Название индикатора | Цвет индикатора в различных средах | ||
| в кислой | в нейтральной | в щелочной | |
| Метиловый красный | красный рН < 4,2 | оранжевый 4,2 < рН< 6,3 | жёлтый рН >6,3 |
| Фенолфталеин | бесцветный рН <7 | бесцветный 7 < pH < 8 | малиновый рН >8 |
| Лакмус | красный рН < 5 | фиолетовый 5< pH < 8 | синий рН > 8 |
Из таблицы 12 следует, что с помощью индикаторов мы можем определить не точное значение рН раствора, а тот интервал, внутри которого это значение может находиться.
Существует также универсальный индикатор, с помощью которого можно определить приблизительное значение (с точностью до единицы) рН раствора в широком интервале от 0 до 14.
Для многих химических и биологических процессов величина рН раствора имеет большое значение. Так, рН крови человека имеет строго постоянное значение 7,36±0,04. Отклонение от него в ту или иную сторону даже на незначительную величину приводит к развитию в организме различных патологических (болезненных) процессов, которые могут завершиться летальным исходом. Растения нормально произрастают, если значение рН почвенного раствора лежит в определённом интервале, характерном для данного вида растения. От величины рН зависят и свойства природных вод, в частности, их коррозионная активность.
studfiles.net
Диссоциация воды. Водородный показатель рН
Kb(I) = 9,55×10–4;
Kb(II) = 3,0×10–8;
Kb = Kb(I) ×Kb(II).
Аналогично для гидроксида свинца можно записать: I ступень: Pb(OH)2 PbOH+ + OH−,
II ступень: PbOH+ Pb2+ + OH−, общее уравнение ионизации: Pb(OH)2 Pb2+ + 2OH−,
В случае разбавленных растворов сильных электролитов можно считать, что их диссоциация происходит практически полностью.
Вода - слабый электролит, по упрощенной схеме ее диссоциацию можно представить следующим уравнением:
Н2О Н+ + ОН− В условиях равновесия константа диссоциации воды
[H+ ][ОН- ]
Кд,с= [h3О]недисс
Поскольку степень диссоциации воды очень мала, то концентрацию недиссоциированных молекул можно принять равной молярной
концентрации жидкой воды. Поэтому при Т=const [H+]×[OH−] =Kд,с[h3O] =const.
Произведение концентраций ионов [H+] и [ОН−] называетсяионным
произведением воды и является постоянной величиной при неизменной температуре и при 298К составляет:
[H+]×[ОН−] =K(h3O) =KВ =Kw =10–14 . | (7.5) |
Ионное произведение воды Кw увеличивается с ростом температуры, так как диссоциация воды–эндотермическийпроцесс. (KW(1000C) =6×10-13)
Для указания концентрации ионов водорода в растворе используют так
называемый водородный показатель: |
|
pH = –lg[H+], | (7.6) |
а для обозначения концентрации гидроксид-ионов- гидроксидный показатель:
pOH = –lg[ОН−] . | (7.7) |
При температуре 298 К |
|
рН + рОН = 14, | (7.8) |
поэтому в чистой воде [H+] = [ОН−] =1×10–7 моль/л, следовательно, рН = рОН = 7;
вкислотной среде [H+] > [ОН−], следовательно, рН < 7, а рОН > 7;
вщелочных растворах [H+] < [ОН−], поэтому рН > 7, а рОН < 7.
Вслучае растворов сильных электролитов вместо концентрации пользуются активностью. Поэтому при необходимости более точных расчетов в таких растворах следует вычислять не рН, а ра(Н+):
ра(Н+) =–lga(H+)= рН – lg γ (Н+).
Произведение растворимости
Понятие произведения растворимости связано с насыщенными растворами малорастворимых сильных электролитов, как правило, солей. Большинство труднорастворимых электролитов в очень разбавленных
растворах диссоциируют полностью, т.е. их можно рассматривать как сильные электролиты. Поэтому все приведенные ниже рассуждения относятся не только к растворам солей, но и к растворам оснований, таких как Al(OH)3, Fe(OH)3, Cu(OH)2 и др.
В случае низкой растворимости электролита образуется крайне разбавленный раствор, который близок к идеальному раствору и можно
использовать концентрационную константу равновесия: Кс = | [Kz1+ ]m [Az2 - ]n |
[Km An (т) ]. | |
Концентрация твердой фазы [КmАn(т)]=const, отсюда: |
|
Кс[КmАn (т)] = [Kz1+ ]m[Az2 − ]n = ПР = const. | (7.9) |
При постоянной температуре в насыщенном растворе произведение концентраций (или активностей) ионов, на которые диссоциирует электролит, с учетом показателей степеней, соответствующих стехиометрическим коэффициентам, есть величина постоянная. Она называется произведением растворимости (ПР) малорастворимого сильного электролита.
Чем меньше значение ПР, тем хуже растворяется соединение. При внесении в раствор избытка ионов Kz1+ илиAz2 − , изменятся концентрации ионов в растворе (сдвиг равновесия диссоциации влево по принципу Ле Шателье). Величина ПР останется постоянной при неизменной температуре, но выпадет дополнительное количество осадка
Условием образования осадка является превышение величины произведения концентраций ионов над величиной произведения растворимости:
Сm(Kz1+ )×Сn(Az2 − ) > ПР
Когда в растворе мала концентрация ионов, то Cm(Kz1+ )×Cn(Az2 − ) < ПР, и электролит будет растворяться до тех пор, пока произведение концентраций ионов не сравняется со значением ПР.
Гидролиз солей
Растворение солей в нейтральной воде часто сопровождается изменением величины pH из-заобразования кислотных или щелочных растворов. Значение рH=7 в нейтральной воде меняется на pH>7 или pH<7. Это явление обусловлено процессом гидролиза.
Гидролиз соли − это обменное взаимодействие ионов соли с молекулами воды, в результате которого образуется слабый электролит и смещается равновесие электролитической диссоциации воды.
Среди обменных реакций с участием электролитов, протекающих в направлении образования слабых электролитов, различают четыре случая взаимодействия соли и воды.
1. Гидролиз практически не происходит, если соли образованы катионами сильного основания и анионами сильной кислотой. Например: KCl, NaNO3, CaSO4. Очевидно, что в этом случае единственным слабым электролитом является вода и взаимодействие типа
KCl + h3O KOH + HCl
не нарушает равновесия Н2О Н+ +ОН–,т.е. в таких растворах рН=7 и равновесие практически полностью смещено влево.
2. Если соли образованы катионами сильного основания и анионами слабой кислоты (KCN, Na3PO4, Ch4COOK и др.), то имеет местогидролиз по аниону. Пример, гидролиз соли К2СО3.
I ступень: К2СО3 + Н2О КНСО3 + КОН
Уравнения гидролиза обычно записывают, указывая сильные электролиты в ионном виде, а слабые – в молекулярном. Данное уравнение может быть записано так:
2К+ + СО32– + Н2О К+ + НСО3− + К+ + ОН− или в сокращенном виде:
СО32− + Н2О НСО3− + ОН−;
Как правило, самопроизвольно гидролиз идет в этом случае в основном по I ступени.
II ступень: КНСО3 + Н2О Н2СО3 + КОН или сокращенноеионно-молекулярноеуравнение:
НСО3− + Н2О Н2СО3 + ОН−.
Видно, что гидролиз по аниону приводит к появлению избытка ионов ОН−, т. е. раствор становится щелочным (рН>7). Для усиления гидролиза по II ступени следует принять меры к сдвигу равновесия.
3. В случае, когда соль образована катионом слабого основания и анионом сильной кислоты (CuSO4, ZnCl2, Nh5NO3 и т.п.), то происходит
гидролиз по катиону. Пример, гидролиз соли ZnCl2.
I ступень: ZnCl2 + h3O Zn(OH)Cl + HCl или сокращенноеионно-молекулярноеуравнение:
Zn2+ + h3O Zn(OH)+ + H+.
II ступень: Zn(OH)Cl +h3O Zn(OH)2↓ + HCl или сокращенноеионно-молекулярноеуравнение:
Zn(OH)+ +h3O Zn(OH)2 + H+.
Избыток ионов водорода в этом случае обусловливает кислотную среду раствора (рН<7).
4. Если соли образованы катионами слабого основания и анионами слабой кислоты, то происходит гидролиз и по катиону и по аниону. Примером может служить гидролиз соли СН3СООNh5:
Ch4COONh5 + Н2О Nh5OH + Ch4COOH. При этом протекают параллельно два процесса:
Nh5+ + h3O Nh5OH + H+
и Ch4СОО− + Н2О Ch4COOH + ОН−.
Растворы солей этого типа могут иметь слабокислотную или слабощелочную реакцию в зависимости от соотношения констант диссоциации образующихся при гидролизе кислоты и основания. Если
studfiles.net
Электролитическая диссоциация воды
Вода является очень слабым амфотерным электролитом:
h3O H+ + OH- ; H 56 кДж. (7.6.8.)
Свободные ионы водорода H+ не способны к существованию в водном растворе - они мгновенно гидратируются водой до гидратов переменного состава (h3n+1On +). Однако, для простоты записи часто используют обозначение H+:
Константа диссоциации воды равна:
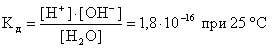 (7.6.9.)
(7.6.9.)
В воде и разбавленных водных растворах электролитов молярная концентрация воды практически постоянна и равна
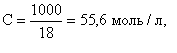
где 1000 - масса 1 л воды, г; 18 - молярная масса воды, г/моль.
Ионное произведение воды
Произведение [H+]·[OH-] можно считать постоянным:
KВ·[h3O] = [H+]·[OH-] = 1,8·10-16·55,6 = 1·10-14 (моль/л)
Произведение равновесных концентраций ионов водорода и гидроксила в воде и разбавленных водных растворах (при постоянной температуре) есть величина постоянная - ионное произведение воды (KВ).
KВ = [H+]·[OH-] = 1·10-14 при 25 С
При увеличении температуры KВ значительно возрастает:
| t, С | 0 | 18 | 25 | 30 | 50 | 60 |
| KВ·1014 | 0,1139 | 0,5702 | 1,0008 | 1,469 | 5,474 | 9,614 |
Следовательно, в чистой воде при 25 ° С
[H+] = [OH-] = 1·10-7 моль/л.
В водных растворах электролитов молярные концентрации ионов H+ и OH- не обязательно равны 10 моль/л (как в чистой воде), но их произведение при 25 С всегда равно 1·10-14. Следовательно, если задано значение [H+], то легко определить и [OH-], и наоборот:
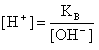
В кислых растворах преобладает концентрация ионов H+:
[H+] > [OH-], т.е. [H+] > 1·10-7 и [OH-] < 1·10-7 моль/л.
В основных растворах преобладает концентрация ионов [OH ]:
[OH-] > [H+], т.е. [OH-] >1·10-7 и [H+] < 1·10-7 моль/л.
Водородный показатель. Кислотность и основность растворов
Для удобства вместо значений [H+] используют водородный показатель pH.
Водордный показатель есть отрицательный десятичный логарифм числового значения молярной концентрации ионов водорода:
pH = -lg[H+]
По аналогии используют гидроксильный показатель (pOH):
pOH = -lg[OH-]
Поскольку KВ = [H+]·[OH-] = const при T = const, то pH + pOH = -lg KВ = f(T).
При 25 С pH + pOH = -lg 1·10-14 = 14, или pH = 14 - pOH.
Величина pH используется как мера кислотности, нейтральности или основности водных растворов:
в кислой среде pH < 7,
в нейтральной среде pH = 7,
в основной среде pH > 7.
Значение pH может быть больше 14 (очень щелочная среда) или отрицательным (очень кислая среда) только при очень больших концентрациях (>10 М/л). Поскольку такие концентрации используются крайне редко, считается, что 0 < рН < 14.
Кислотно-основные индикаторы
Существуют различные методы определения концентрации ионов водорода (и, соответственно, гидроксид-ионов). Один из простейших методов основан на использовании кислотно-основных индикаторов. В качестве таких индикаторов служат органические кислоты и основания, которые резко изменяют свою окраску в определенном узком интервале pH. Обычно стараются подобрать индикатор с узким интервалом перехода (не более двух единиц pH). В табл.6.3 показаны интервалы перехода окраски важнейших кислотно-основных индикаторов.
Часто используют смеси индикаторов - универсальные индикаторы, которые способны многократно изменять окраску: определенному интервалу pH (иногда узкому, до 0,2 единиц) отвечает характерная окраска, присущая одному из индикаторов смеси. Наиболее точным методом определения pH является потенциометрический, основанный на измерении зависимости потенциала электрода от концентрации ионов водорода в исследуемом растворе.
Таблица 6.3.
studfiles.net
Диссоциация воды. Водородный показатель
Чистая вода очень плохо проводит электрический ток, но всё же обладает измеримой электропроводностью, которая объясняется частичной диссоциацией молекул Н2О на ионы водорода и гидроксид-ионы:
Н2О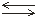 Н++ ОН–
Н++ ОН–
По величине электропроводности чистой воды можно вычислить концентрацию в ней ионов Н+и ОН–. При 25оС она равна 10-7моль/л.
Константа диссоциации Н2О рассчитывается следующим образом:
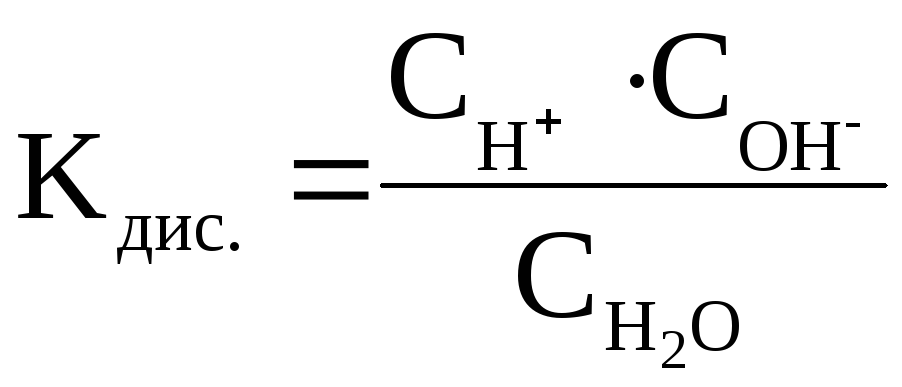
Перепишем это уравнение:
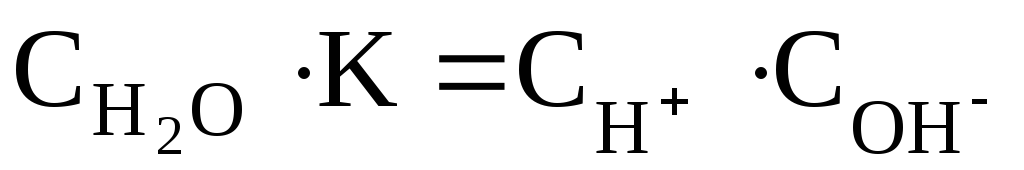
Следует подчеркнуть, что данная формула содержит равновесные концентрации молекул Н2О, ионов Н+и ОН–, которые установились на момент наступления равновесия в реакции диссоциации Н2О.
Но, поскольку степень диссоциации Н2О очень мала, можно считать, что концентрация недиссоциированных молекул Н2О в момент наступления равновесия практически равна общей начальной концентрации воды, т.е. 55,56 моль/дм3(1 дм3Н2О содержит 1000 г Н2О или 1000 : 18 ≈ 55,56 (молей). В разбавленных водных растворах можно считать, что концентрация Н2О будет такой же. Поэтому, заменив в уравнении (42) произведение двух постоянных величин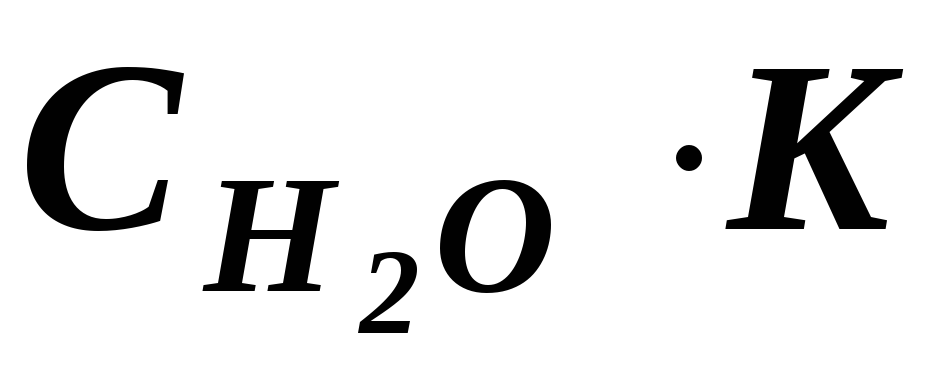 новой константой
новой константой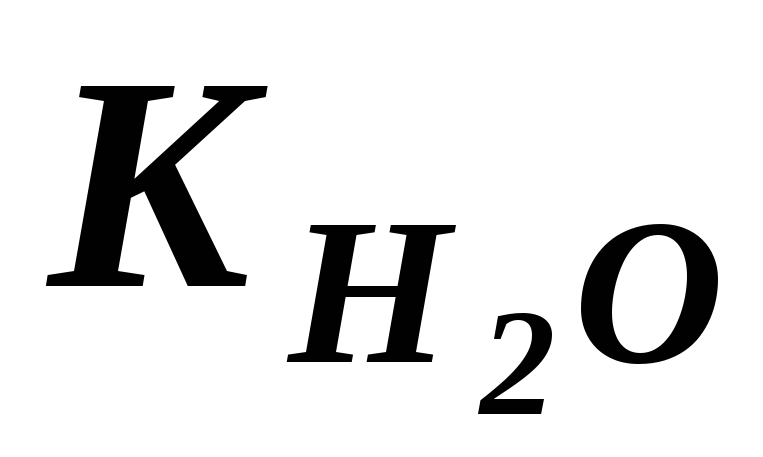 (илиKW), будем иметь:
(илиKW), будем иметь:
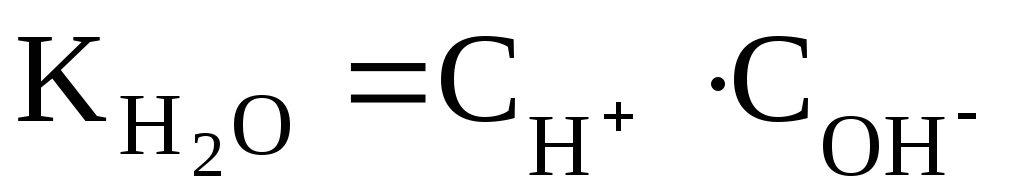
Полученное уравнение показывает, что для воды и разбавленных водных растворов при неизменной температуре произведение молярных концентраций ионов водорода и гидроксид-ионов есть величина постоянная. Она называется иначе ионным произведением воды.
В чистой воде при 25оС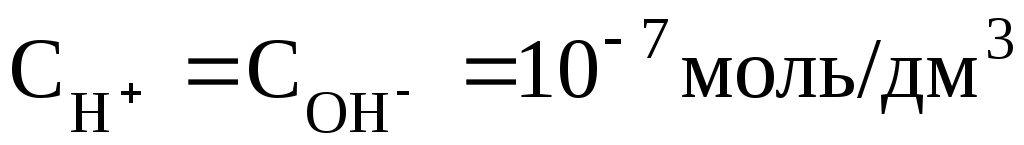 . Поэтому для указанной температуры:
. Поэтому для указанной температуры:
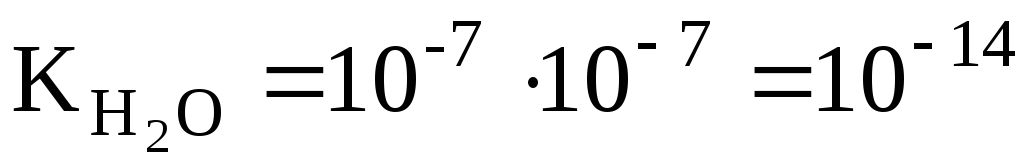
При увеличении температуры значении 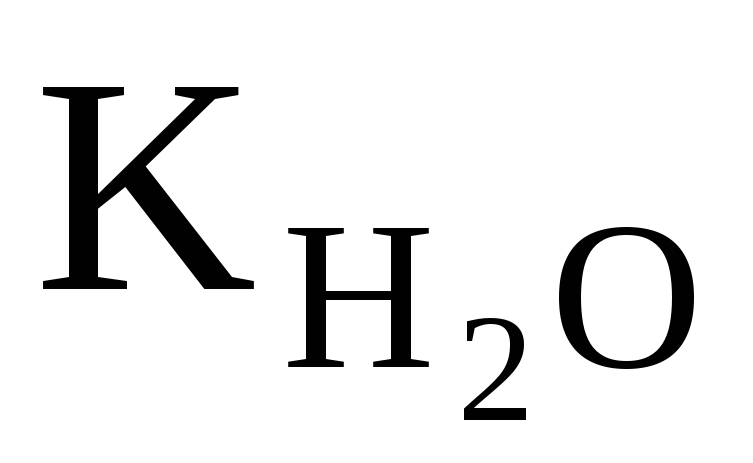 возрастает. При 100оС оно достигает 5,5 ∙ 10-13(рис. 34).
возрастает. При 100оС оно достигает 5,5 ∙ 10-13(рис. 34).
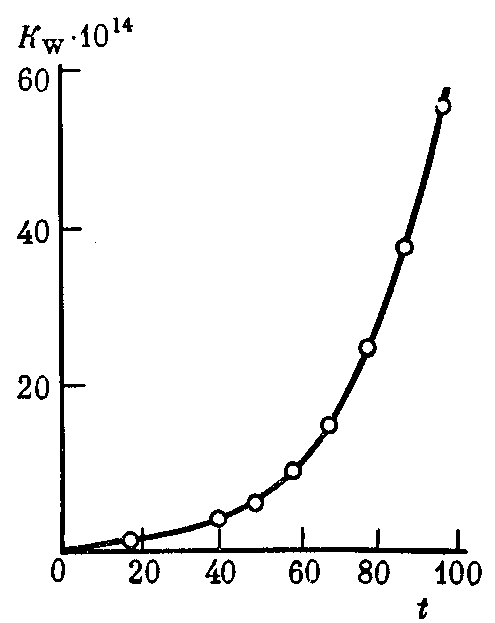
Рис. 34. Зависимость константы диссоциации воды Kw от температурыt (°С)
Растворы, в которых концентрации ионов Н+ и ОН– одинаковы, называются нейтральными растворами. В кислых растворах больше содержится ионов водорода, а в щелочных – гидроксид-ионов.Но какова бы ни была реакция среды в растворе, произведение молярных концентраций ионов Н+и ОН–останется постоянным.
Если, например, к чистой Н2О добавить некоторое количество кислоты и концентрация ионов Н+при этом увеличится до 10-4моль/дм3, то концентрация ионов ОН–соответственно понизится так, что произведение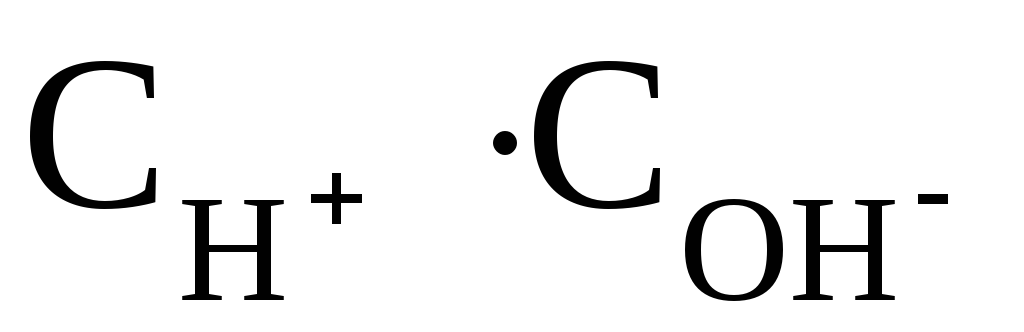 останется равным 10-14. Следовательно, в этом растворе концентрация гидроксид-ионов будет равна 10-14: 10-4= 10-10моль/дм3. Этот пример показывает, что если концентрация ионов водорода в водном растворе известна, то тем самым определена и концентрация гидроксид-ионов. Поэтому, реакцию раствора можно количественно охарактеризовать концентрацией ионов Н+:
останется равным 10-14. Следовательно, в этом растворе концентрация гидроксид-ионов будет равна 10-14: 10-4= 10-10моль/дм3. Этот пример показывает, что если концентрация ионов водорода в водном растворе известна, то тем самым определена и концентрация гидроксид-ионов. Поэтому, реакцию раствора можно количественно охарактеризовать концентрацией ионов Н+:
нейтральный раствор 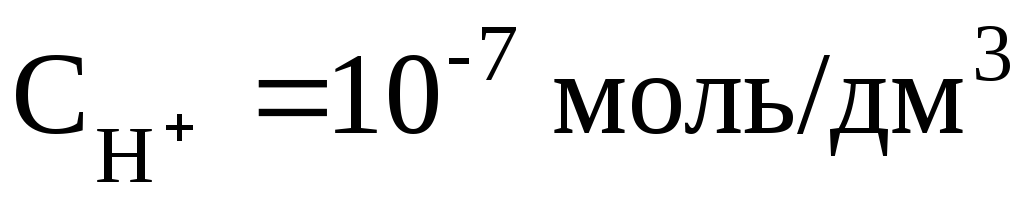
кислый раствор 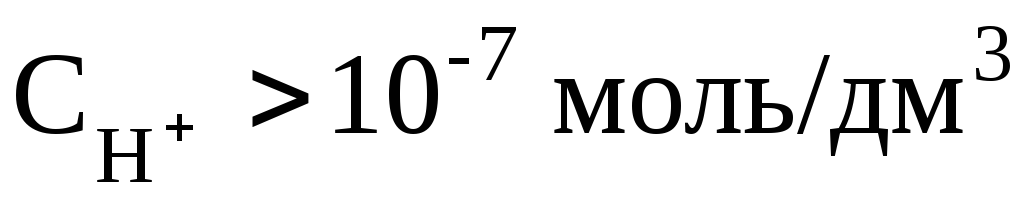
щелочной раствор 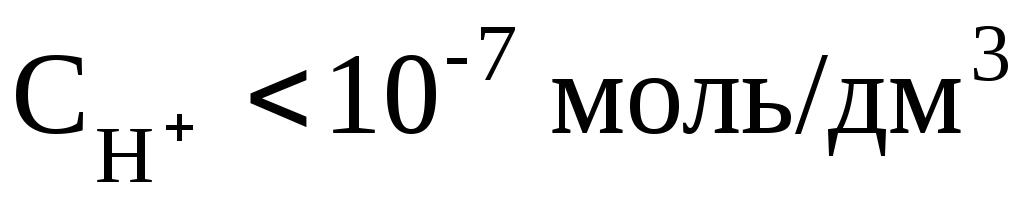
На практике для количественной характеристики кислотности или щёлочности раствора используют не молярную концентрацию в нём ионов Н+, а её отрицательный десятичный логарифм. Эта величина называетсяводородным показателем и обозначается черезрН:
рН = –lg[H+]
Например, если 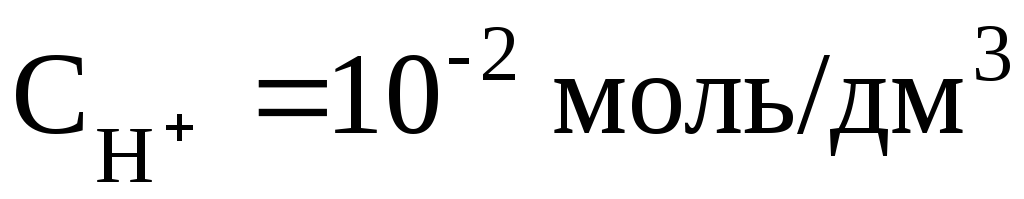 , то рН = 2; если
, то рН = 2; если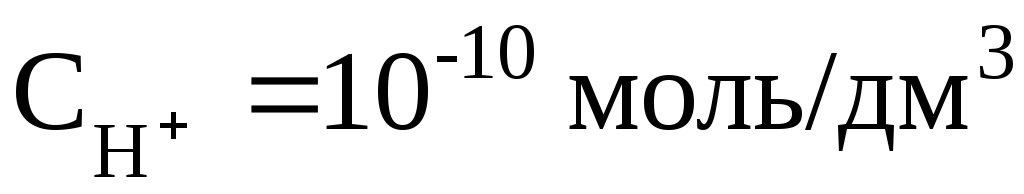 , то рН = 10. В нейтральном растворе рН = 7. В кислых растворах рН < 7 (и тем меньше, чем «кислее» раствор, т.е. чем больше в нём концентрация ионов Н+). В щёлочных растворах рН > 7 (и тем больше, чем «щелочнее» раствор, т.е. чем меньше в нём концентрация ионов Н+).
, то рН = 10. В нейтральном растворе рН = 7. В кислых растворах рН < 7 (и тем меньше, чем «кислее» раствор, т.е. чем больше в нём концентрация ионов Н+). В щёлочных растворах рН > 7 (и тем больше, чем «щелочнее» раствор, т.е. чем меньше в нём концентрация ионов Н+).
Для измерения рН раствора существуют различные методы. Очень удобно приблизительно оценивать реакцию раствора с помощью специальных реактивов, называемых кислотно-основными индикаторами. Окраска этих веществ в растворе меняется в зависимости от концентрации в нём ионов Н+. Характеристика некоторых наиболее распространённых индикаторов представлена в таблице 12.
Таблица 12.Важнейшие кислотно-основные индикаторы
| Название индикатора | Цвет индикатора в различных средах | ||
| в кислой | в нейтральной | в щелочной | |
| Метиловый красный | красный рН < 4,2 | оранжевый 4,2 < рН< 6,3 | жёлтый рН >6,3 |
| Фенолфталеин | бесцветный рН <7 | бесцветный 7 < pH < 8 | малиновый рН >8 |
| Лакмус | красный рН < 5 | фиолетовый 5< pH < 8 | синий рН > 8 |
Из таблицы 12 следует, что с помощью индикаторов мы можем определить не точное значение рН раствора, а тот интервал, внутри которого это значение может лежать.
Существует также универсальный индикатор, с помощью которого можно определить приблизительное значение (с точностью до единицы) рН раствора в широком интервале от 0 до 14.
Для многих химических и биологических процессов величина рН раствора имеет большое значение. Так, рН крови человека имеет строго постоянное значение 7,36±0,04. Отклонение от него в ту или иную сторону даже на незначительную величину приводит к развитию в организме различных патологических (болезненных) процессов, которые могут завершиться летальным исходом или смертью. Растения нормально произрастают, если значение рН почвенного раствора лежит в определённом интервале, характерном для данного вида растения. От величины рН зависят и свойства природных вод, в частности, их коррозионная активность.
20
studfiles.net



















