Борная кислота. Получение и применение. Борная вода
Формула борной кислоты в химии
Данная статья будет посвящена борной кислоте, которая широко применяется в самых разных сферах деятельности и известна практически каждому человеку. Формула борной кислоты предельно проста для запоминания. В статье будут рассмотрены общая характеристика и свойства борной кислоты, области ее применения и нахождения в природе.
Что такое борная кислота
Формула борной кислоты в химии известная многим. Она довольно слабая по сравнению с "коллегами". Ее активно используют для химических опытов в школах. Формула борной кислоты - h4Bo3.
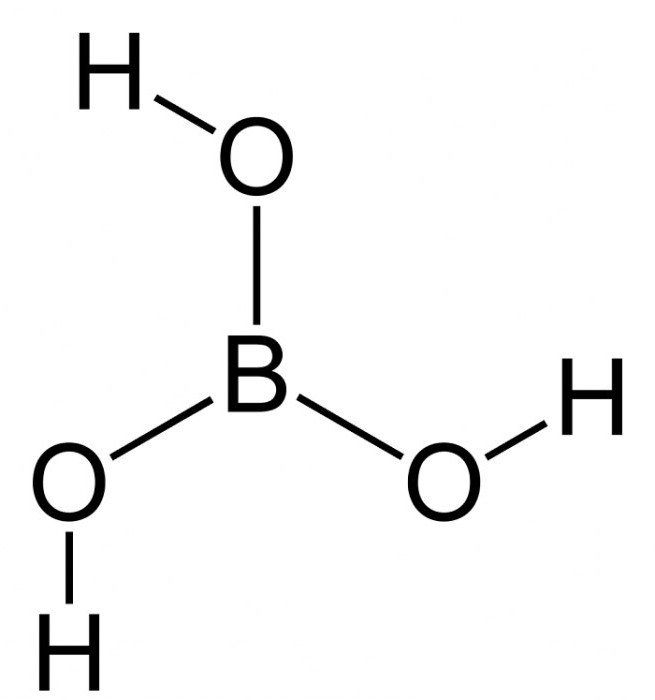 Борная кислота - это кристаллический порошок, не имеющий цвета и запаха. Молекулы триклинной слоистой решетки соединены между собой водородными связями и образуют плоские слои. Таким образом и строится молекула борной кислоты.
Борная кислота - это кристаллический порошок, не имеющий цвета и запаха. Молекулы триклинной слоистой решетки соединены между собой водородными связями и образуют плоские слои. Таким образом и строится молекула борной кислоты.
Представленное вещество имеет слабовыраженные свойства кислот - в воде растворяется плохо. Одной из особенностей является то, что свойство кислоты h4Bo3 придает присоединение аниона гидроксильной группы. У других кислот наблюдается способность к отщеплению H+ протона.
При образовании гидросульфата бора B(HSO4)3, который весьма слабоустойчив, борная кислота может проявлять довольно слабые признаки амфотерности. Если соединение подвергнуть термическому воздействию, борная кислота будет способна растворять металлы оксидов, в результате чего образуются соли. Формула нашего химического соединения в присутствии серной кислоты в концентрированном виде может образовать эфиры:
| h4Bo3 + 3Ch4OH → 3h3O + B(OCh4)3 |
Во время протекания процесса нейтрализации щелочами в растворах воды, ортобораты, содержащие (BO3)3, не образуются. Это явление объясняется тем фактом, что они при нейтрализации почти полностью гидролизируются из-за чрезмерно малого количества константы [B(Oh4)-. В результате этой реакции в растворе начинают образоваться соли полиборной кислоты, например, метабораты, тетрабораты и другие:
| 2NaOH + 3h4Bo3 → Na2B4O7 + 7h3O |
Если щелочи присутствуют в избытке, то они могут перейти в метабораты:
| 2NaOH + Na2B4O7 → 4NaBO2 + h3O |
И тетра-, и метабораты способны к гидролизу, но в сравнении с ортоборатами имеют меньшую степень склонности.
Борная кислота в природе
Борная кислота, формула химическая которой h4Bo3, часто встречается в природе в практически свободном виде - в минерале сассолине. Более того, эта кислота входит в состав воды практически каждого горячего природного источника. Довольно большое количество h4Bo3 содержится в подземных минеральных водах, которые необычайно полезны для здоровья.
Использование h4Bo3 человеком
 Как говорилось выше, формула борной кислоты известная практически каждому. Это связано с довольно широким спектром использования ее в повседневной жизни: физики-ядерщики, ювелиры, электрики, врачи и обычные граждане - все применяют борную кислоту. Она применяется как антисептик и антипирен. Борной кислотой защищают древесину, добавляют ее в земельные удобрения.
Как говорилось выше, формула борной кислоты известная практически каждому. Это связано с довольно широким спектром использования ее в повседневной жизни: физики-ядерщики, ювелиры, электрики, врачи и обычные граждане - все применяют борную кислоту. Она применяется как антисептик и антипирен. Борной кислотой защищают древесину, добавляют ее в земельные удобрения.
Химический состов используют как поглотитель нейтронов в ядерных реакторах, в медицине h4Bo3 раствором с содержаниям вещества в два процента используют в качестве антисептика для обеззараживания поверхности кожи.
Фотографы используют ее в качестве проявителя мелкозернистого типа. С ее помощью создается кислая среда для фиксажей.

Литейщики используют борную кислоту как связующее вещество во время футеровки печи.
В быту человек использует ее для борьбы с насекомыми.
Кислота активно используется в косметологии для уходом за проблемной кожей.
В пищевой промышленности борная кислота носит название добавки E284, а в лабораториях на ее основе готовят буферные растворы.
Формула борной кислоты h4Bo3 используется при производстве керамики, стекла, стекловолокна и оптоволокна.
Множество комбинированных препаратов группы ATX D08AD одним из компонентов имеют борную кислоту.
Ювелиры используют её во время пайки сплавов, в состав которых входит золото, в качестве основы флюсоф для пайки.
Опасна ли борная кислота?
 Борная кислота не является опасной и может нанести вред лишь при безрассудном применении. Смертельная концентрация в организме ребенка составляет от 4 до 5 г, а в теле взрослого человека около 15-20 г. Так как h4Bo3 не выводится из организма достаточно длительное время, она может постепенно накапливаться вплоть до смертельной дозы при частом и регулярном неправильном применении.
Борная кислота не является опасной и может нанести вред лишь при безрассудном применении. Смертельная концентрация в организме ребенка составляет от 4 до 5 г, а в теле взрослого человека около 15-20 г. Так как h4Bo3 не выводится из организма достаточно длительное время, она может постепенно накапливаться вплоть до смертельной дозы при частом и регулярном неправильном применении.
В заключении можно сказать, что h4Bo3 является незаменимым веществом в жизни и деятельности человека.
fb.ru
Растворимость в воде борной кислоты
Растворимость борной кислоты в 100 мл воды 1,95 г при [c.297]Борная кислота хорошо растворима в воде, а также в некоторых органических растворителях. Несмотря на наличие трех гидроксогрупп, в водных растворах она проявляет себя как одноосновная кислота вследствие образования гидроксокомнлекса [c.140]
Состав растворителя, вес. 7о Растворимость I борной кислоты в водном растворе нитрата калия, г 100 г воды [ Состав растворителя, вес. " Растворимость борной кислоты в водном растворе нитрата калия, г 100 г воды [c.151]
Борная кислота кристаллизуется из горячей воды в виде бесцветных чешуйчатых кристаллов. На холоду она плохо растворима (около 4 г в 100 г воды). Борная кислота относится к очень слабым кислотам. Применение борной кислоты ib медицине (водные растворы) объясняется тем, что она является слабым антисептическим средством. Обычно применяется 1—2% раствор борная кислота входит также в состав различных мазей. [c.270]По-видимому, в растворе образуются и соли орто- и мета-борных кислот, но растворимость тетрабората наименьшая, а сила кислоты Н2В4О7 наибольшая, и равновесие смещено в сторону образования тетрабората. Из воды тетраборат натрия выпадает в виде кристаллогидрата— N326407 ЮН2О (бура). [c.252]
БУРА (тетраборат натрия) NajBiO, X X IOh3O — соль тетраборной кислоты Н2В4О7, не выделенной в свободном состоянии. В природе Б. встречается в виде минералов, содержится в минеральных и нефтяных водах, в выделениях грязевых вулканов. Б. образует большие бесцветные прозрачные кристаллы, которые на воздухе выветриваются и мутнеют умеренно растворима в воде. Б. получают из борной кислоты, из минералов — тинкаля, кернита и других, а также из воды соляных озер. С оксидами различных металлов Б. образует окрашенные соединения — бораты ( перлы буры ), растворимые в воде, что исполь- [c.48]
Растворимость борной кислоты в 100 лл воды при О °С — 1,95 г, при 100 С — 39,1 г. В минеральных кислотах растворяется хуже, [c.46]
Борная кислота — бесцветные, блестяш.не слегка жирные на ощупь чешуйки или мелкий кристаллический порошок без запаха, растворимый в 25 ч. воды, в 3 ч. кипящей воды, в 25 ч. спирта, довольно легко в глицерине. Борная кислота летуча с парами воды или спирта. [c.66]
В воде растворимы только бораты наиболее активных одновалентных металлов. При нейтрали, ации щелочью раствора орто-борной кислоты получается тетраборат, который избытком щелочи может быть переведен в метаборат [c.137]
Сернокислый магний и сернокислый натрий предназначаются для повышения электропроводности раствора, хлористый натрий — для повышения растворимости никелевого электрода, а борная кислота способствует поддержанию постоянной величины pH. Все компоненты растворяют в горячей воде, и затем раствор фильтруют. [c.245]
Помимо воды, борная кислота хорошо растворима в спирте (90 г/л), хуже растворима она в ацетоне (5 г/л) и почти нерастворима в эфире (0,08 г/л). Взаимодействие с глицерином усиливает кислотные свойства Н3ВО3. Они возрастают также по мере повышения концентрации самой кислоты. Так, при переходе от 0,03 к 0,75 Л1 водному раствору pH изменяется от 5,3 до 3,7, что связано, по-видимому, с частичным образованием полиборных кислот (предположительно, три- и гексаборной). [c.168]
Вещества, состоящие из небольших неполярных молекул, например кислород, азот и метан, растворяются в воде примерно в 10 раз хуже, чем в неполярных растворителях. Вещества, состоящие из более крупных неполярных молекул, по существу не растворяются в воде, но, как правило, хорошо растворяются в неполярных растворителях. Вода как бы противодействует включению этих молекул, поскольку образование необходимых для этого пустот сопряжено с разрывом или деформацией водородных связей между молекулами воды. Соединения, подобные бензину и нафталину, не растворяются в воде, поскольку их молекулы в растворе мешали бы молекулам воды образовывать столь же большое число прочных водородных связей, как в чистой воде с другой стороны, борная кислота растворима в воде потому, что уменьшение числа связей между молекулами воды компенсируется образованием прочных водородных связей между молекулами воды и гидроксильными группами молекул борной кислоты. [c.262]
Борная кислота (ортоборная кислота) Н3ВО3 — чешуйчатые бесцветные кристаллы с блеском, т. пл. 169° С растворима в воде. Б. к. относится к слабым кислотам. Встречается в природе В виде минерала сассолина, в горячих источниках и минеральных водах. Б. к. широко известна как дезинфицирующее вещество, применяется также в лабораторной практике для приготовления буферных растворов, в сельском хозяйстве как борное микроудобрение. [c.46]
Для защиты стальных изделий от коррозии в замкнутых охладительных, отопительных системах и водяных системах, работающих на повышенных давлениях и температурах, применяется ингибитор антикор II, представляющий собой комплексное соединение борной кислоты с глюконатом кальция или натрия. Это белый кристаллический порошок, хорошо растворимый в воде. Для защиты от коррозии стальной аппаратуры его вводят в воду в количестве от 0,01 до 0,05 %. [c.98]
Более обычный вариант экстракции — это растворение выделяемого полисахарида. Растворителем, применяемым в подавляющем большинстве случаев, является вода. В холодной воде растворимы растительные слизи, некоторые бактериальные полисахариды, гликопротеины. Повышение растворимости может быть достигнуто нагреванием, а также изменением pH. Так, многие полисахариды с кислотными функциональными группами, например сульфированные полисахариды, находящиеся в природе в виде солей, легче растворяются в разбавленных минеральных кислотах. Растворимость других классов полисахаридов, напротив, повышается в щелочной среде например, камеди, нерастворимые в воде, растворяются в 1—5/о-ных растворах щелочи для экстракции гемицеллюлоз применяют более концентрированные щелочные растворы. Иногда при экстракции полисахаридов используют растворы солей, эффективно разрывающих водородные связи, например растворы тиоцианата лития , или растворы комплексообразователей, например солей борной кислоты . Гораздо реже и только в специальных случаях полисахариды извлекают другими растворителями — диметилсульфоксидом , диметилформами-дом, водным спиртом . С помощью этих растворителей часто удается избирательно экстрагировать полисахариды со сравнительно невысоким молекулярным весом или с большим количеством малополярных заместителей, например ацетильных групп. [c.483]
Являетея кислотным оксидом. Взаимодействует с водой с образованием борной кислоты (растворима только а горячей воде). [c.309]
Борная кислота - твердое вещество, заметно растворимое в воде (5 г/100 г воды при 20 °С) и некоторых органических растворителях. Кристаллы борной кислоты имеют слоистую структуру, в которой молекулы связаны прочными водородными связями. Частичное удаление воды ведет к образованию связей В—О— В, при этом в решетке чередуются плоские треугольные фрагменты ВО3 и тетраэдрические ВО4. В результате появляется большое число по- [c.318]
Свойства. Кристаллическая борная кислота представляет собой бесцветные с перламутровым блеском чешуйки, легко растворимые в воде (100 ч. еоды растворяют при 1 5° 4 ч. борной кислоты и 33 ч. при 100°). [c.413]
Выполнение опыта. В пробирку с раствором тетрабората натрия прилить несколько капель хлороводородной кислоты. Охладить пробирку с раствором водой из-под крана для уменьшения растворимости полученной борной кислоты. Наблюдать выделение кристаллов Н3ВО3. [c.152]
Растворимость борной кислоты Н3ВО3 в воде при 13 С равна 38,5 г в I л раствора и 49,1 г при 20 С. Вычислите термодинамические характеристики процесса растворения. [c.186]
Борная кислота Н3ВО3 растворяется в воде умеренно (при 20°С в 100 г Н2О растворимо 4,9 г h4BQ3). Раствор борной кислоты обладает слабокислой реакцией (/Сд сс = 7,3-10 "). [c.289]
Борная кислота Н3ВО3 —белое кристаллическое полимерное вещество, плохо растворимое в воде. Она очень слабо диссоциирует (рХ=9,24). В щелочном растворе Н3ВО3 дает производные [c.477]
Соли борных кислот —бораты —плохо растворимы в воде (кроме боратов щелочных металлов). Бораты тяжелых металлов окрашены, из расплавов застывают в виде стекол (перлов буры), например СоВ02-2ЫаВ02 (синий перл), ЗМаВОа-Сг(ВОз)з (зеленый перл.). [c.478]
В воде растворимы лишь бораты щелочных металлов. Их растворы сильно гидролизованы и имеют щелочную реакцию. Наиболее важные соединения бора - борная кислота Н3ВО3 и бура Na2B407 10 Н О. [c.60]
Борная кислота Н3ВО3 — бесцветное кристаллическое вещество, хорошо растворимое в горячей воде, [c.371]
Наибольшее практическое значение из соединений бора имеют кислородные соединения. Оксид В2О3 имеет ярко выраженные кислотные свойства при взаимодействии с водой образует ортоборную кислоту Н3ВО3. Орто-борная кислота — белые, чешуйчатые кристаллы, хорошо растворимые в горячей воде. Это очень слабая кислота ( 1 = 6-10- ). [c.171]
Одно из этих правил гласит, что вещество имеет тенденцию растворяться в таких растворителях, которые химически подобны ему. Так, углеводород нафталин СюНв обладает высокой растворимостью в бензине, представляющем собой смесь углеводородов, несколько меньшей растворимостью — в этиловом спирте С2Н5ОН, молекулы которого состоят из коротких углеводородных цепей с гидроксильными группами, и очень плохой растворимостью — в воде, которая сильно отличается от углеводородов. В то же время борная кислота В(ОН)з, являющаяся гидроокисью, обладает умеренной растворимостью в воде и в спирте, т. е. в -веществах, которые содержат гидроксильные группы, и нерастворима в бензине. Три указанных растворителя сами подтверждают то же правило как бензин, так и вода смешиваются со спиртом (растворяются в нем), в то время как бензин и вода взаимно растворяются лишь в очень небольших. количествах. [c.261]
Борная кислота легко образует высококонденсированные кислоты, подобные кремневым кислотам, а боратные стекла по свойствам напоминают силикатное стекло. Стекло пирекс служит для изготовления химической стеклянной и жаростойкой посуды это боралюмосиликатное стекло, содержащее лишь 4% ионов щелочных и щелочноземельных металлов. Такое стекло не обладает свойственной обычному стеклу очень слабой растворимостью в воде, а также имеет меньший коэффициент термического расширения, вследствие чего оно не трескается при резких сменах температур. [c.535]
Одним ИЗ важнейших технологических полупродуктов является тетрафторид урана UF4, труднорастворимое соединение (растворимость в воде при 25° равна 1-10 моль л) для перевода его в раствор пользуются рядом способов. Часто перед растворением UF превращают в закись-окись прокаливанием при 800—900°. Кислоты-окислители, например дымящая H IO4, быстро растворяют тетрафторид урана с образованием соли уранила и HF. Азотная кислота действует на UF медленно, но добавление борной кислоты усиливает растворяющее действие HNO3 (так же, как и других кислот) вследствие связывания F -hohob по реакции [c.349]
Реакцию чаще всего проводят в воде или в смеси воды и какого-либо органического растворителя спирта, тетрагидрофурана и т. п., что очень удобно, учитывая особенности растворимости моносахаридов. Значение pH 10—10,5 является оптимальным для протекания реакции поскольку боргидриды наиболее устойчивы в слабощелочной среде, а также потому, что гидроксил-ион катализирует превращение циклической полуацетальной формы в ациклическую, которая и подвергается восстановлению. Увеличение pH ведет к ускорению гидролиза боргидрид-иона и к усилению побочных реакций вследствие превращений моносахарида под действием основания (см. стр. 97 и сл.). Уменьшение pH вызывает усиление распада боргидрид-иона с выделением водорода. Восстановление моносахаридов протекает достаточно быстро уже при 20° С и заканчивается, в среднем, через 1—2 ч. Избыточный боргидрнд разрушают добавлением разбавленной соляной или уксусной кислоты борную кислоту удаляют, нагревая кислый раствор с метанолом и отгоняя образующийся метил-борат неорганические соли удаляют обычно с помощью ионообменных смол. Выходы полиолов очень высоки (около 90- о) . [c.79]
chem21.info
Борная кислота. Получение и применение.
 Борная кислота – это неорганическое бесцветное вещество, состоящее из чешуйчатых кристаллов. Кислота очень слабая и односоставная, плохо растворяется в воде. Она не имеет запаха и горькая на вкус. Она начинает плавиться при температуре 170°С и растворяться в воде при температуре 20°С. Борная кислота представлена в разных вариациях: порошок, жидкость и мазь.
Борная кислота – это неорганическое бесцветное вещество, состоящее из чешуйчатых кристаллов. Кислота очень слабая и односоставная, плохо растворяется в воде. Она не имеет запаха и горькая на вкус. Она начинает плавиться при температуре 170°С и растворяться в воде при температуре 20°С. Борная кислота представлена в разных вариациях: порошок, жидкость и мазь.
Химическая формула h4BO3.
Она оказывает противогрибковое, антибактериальное, противопаразитное и дезинфицирующие действие.
Борная углекислота считается мощным и опасным веществом для человека, но если правильно применять ее, то она принесет только пользу для вашего здоровья.
Получение борной кислоты
В промышленности борную кислоту добывают с помощью действия серной кислоты на борсодержащие элементы.
Также иногда для образования чистейшей борной кислоты, делают следующие: к раствору горячей воды и боры(1 часть боры на 4 части воды) добавляют соляную кислоту. Чтобы узнать верно ли, все ингредиенты смешаны, в раствор отпускают лакмусовую бумажку и если она окрашивается в ярко-красный, то значит смешано все верно. После всего этого раствор остужают и отделяют борную кислоту отжиманием и затем перекристаллизируют.
Транспортировка, хранение и меры предосторожности при пользовании
Хранить ее нужно только в заводской упаковке в прохладном и отлично обдуваемом месте. Обязательно нужно содержать ее в закрытой упаковке. Нельзя содержать борную кислоту рядом с сильными окислителями и основаниями, а также с солнечным светом и источниками возгорания.
При использовании кислоты нельзя курить, пить и есть. Одежду после работы с ней нужно обязательно промывать.
Она очень опасна при больших дозировках и долгом применении, так как быстро накапливается в организме и разрушает его. Признаки передозировки: тошнота, рвота, головные боли, высыпание на коже и шелушения.
Борную кислоту ни в каком виде нельзя применять с целью промывания слизистых, так как это может послужить причиной смерти.
Применение борной кислоты:
-
В домашнем быту
В домашнем обиходе борную кислоту применяют с целью войны с муравьями и тараканами. Также ее применяют как удобрение и подкормку для растений.
Рецепт для борьбы с тараканами:
Борную кислоты в порошке рассыпают тоненьким слоем в шкафчиках, в ванной комнате, под раковиной, у батарей и труб, а кроме этого еще и вдоль плинтусов, и иных зон появления тараканов. Порошок убирают спустя 4 дня влажной тряпкой, если есть необходимость, то повторить процедуру через неделю.
«Важно! Если у вас есть домашние животные или маленькие дети, то такой способ вам запрещен!»
Борную кислоту замешивают с яичным желтком, катают маленькие шарики и раскладывают на участках скопления тараканов. Оставлять такие приманки нужно на 2-3 недели.
Против муравьев:
Мясной фарш смешивают с кислотой и раскладывают в места наибольшего скопления насекомых.
В горячей воде нужно растворить сахар и кислоту, после раствор охладить и добавить мед или варенье. Приманка раскладывается везде, где были замечены вредители.
Против нагара:
Борная кислота отлично удаляет нагар со сковородок и кастрюль. Раствор или порошок кислоты следует нанести на посуду и оставить на 5-10 минут, после чего хорошенько промыть посуду в горячей воде с моющим средством. Кислоту наносить нужно обязательно в резиновых перчатках.
Для растений:
Использование кислоты весьма полезно в огороде и саде. Препараты на основе бора используют для опрыскивания семян перед их посадкой, поливку грунта перед посадкой садовых культур, а также используют как подкормку и обрызгивание садовых и огородных культур для хорошего урожая и уничтожения болезней.
В медицине борная углекислота применяется при лечении разных болезней и недугов. Ее применяют в медицине при лечении:
При заболевании глаз.
Ее применяют при лечении конъюнктивита. Ее закапывают по 2-3 капли в каждый глаз до полного избавления от болезни. Помните, что использовать борную кислоту для глаз можно только после консультации у врача.
При заболевании уха
Борную кислоту при болях в ушах применяют в виде капель и ваты, которую смачивают в ней. Закапывать кислоту нужно по две капли в каждое ухо, три-четыре раза в день до полного выздоровления. Смоченная вата устанавливается в ухо и сверху вкладывает либо сухая ватка, либо можно надеть шапку для большего эффекта.
«Важно! Использовать борную кислоту можно только после консультации с вашим врачом!»
Использование кислоты в косметологии
Кислота помогает быстро и эффективно устранить прыщи, угри, сыпь, а также блеск с лица у людей с жирной кожей. Еще борной кислотой можно отбелить кожу и удалить веснушки.
Слабым раствором бороной кислоты протирают проблемные места, а прыщи два раза в день прижигаются ватой смоченной в кислоте.
При лечении грибка
Для лечения грибка отлично подходит кислота в порошке, растворе и мази. С порошка бора хорошо делать теплые ванночки для ног, а мазь лучше принимать для ногтей.
дезинфицирующее средство
В фотографиях
В ювелирном деле
Ее используют как базу для флюсов для пайки золотосодержащих сплавов.
-
В промышленности
Ее часто применяют в изготовлении стекловолокна, стекла в ЖК-дисплеи с плоской панелью. Также ее добавляют при изготовлении пластмассы. Борную кислоту применяют как антипирены для древесины, текстильных изделий, хлопка и т.д.
-
В металлургии
Применяют в качестве уплотнителя разноцветных металлов и раскислителя.
-
В ядерных реакторах
В качестве поглотителей нейтронов, которые растоплены в теплоносители.
Борная кислота весьма полезна и эффективна в многочисленных отраслях. Самое важное это применять ее в разумных пределах, чтобы она приносила только лишь пользу и ни в коем случае не вредила вам и вашим близким. Перед использованием читайте инструкцию и используйте меры предосторожности при работе с ней.
hawkish.ru
Борная кислота для глаз: свойства, способы приготовления раствора
Борная кислота для глаз часто применяется в народной медицине для лечения различных патологий органов зрения. Такое вещество использовали для дезинфекции еще наши бабушки и прабабушки. Однако использовать борную кислоту нужно очень осторожно, так как медики выявили некоторые побочные явления от использования такого раствора. Чаще всего сегодня такой препарат применяют для избавления от конъюнктивита и воспаления слизистой глаза. Примечательно, что использовать раствор борной кислоты для промывания глаз можно как для взрослых пациентов, так и для детей.
Ванны для глаз с раствором борной кислоты
Органы зрения ежедневно испытывают большие нагрузки. Мы работаем за компьютером, смотрим телевизор, в глаза постоянно попадает пыль, грязь, дым и многие другие раздражители. Чтобы оздоровить глаза и защитить их от развития опасных инфекционных заболеваний, рекомендуется ежедневно делать специальные ванночки с раствором борной кислоты. Проводить такую процедуру лучше всего в вечернее время, непосредственно перед сном.

Свойства борной кислоты
Раствор препарата нужно смешать с небольшим количеством теплой кипяченой воды. Ниже будет подробно описано, как развести борную кислоту для промывания глаз. Итак, лечебная жидкость готова. Теперь приступаем непосредственно к ванночкам.
- Вылейте жидкость в небольшую, но глубокую емкость.
- Медленно опустите в раствор борной кислоты лицо, и попытайтесь несколько раз поморгать.
- Аккуратно протрите мокрое лицо и глаза чистым полотенцем без ворса.
Выполнить такую процедуру взрослым намного проще, чем детям. Малыши часто боятся открывать глаза в воде. Если ваше чадо категорически отказывается «нырять» в раствор борной кислоты, просто протрите ребенку глаза ватным тампоном, обильно смоченным в лекарстве. Предварительно маленький пациент должен сильно запрокинуть голову назад.
Для оздоровления органов зрения можно использовать только аптечную борную кислоту. Техническое вещество не только не поможет обеззаразить глаза, но еще и нанесет огромный вред.
Как правильно приготовить раствор борной кислоты для глаз?
Чтобы промывание глаз борной кислотой оказалось эффективным и безопасным, нужно предварительно обязательно проконсультироваться с врачом, и убедиться в том, что у вас нет противопоказаний к такому методу лечения.

Порошок борной кислоты — лучшее дезинфицирующее средство для глаз
Использовать такое средство рекомендуется, если вы почувствовали даже незначительный дискомфорт в области глаз. Борная кислота действительно помогает избавиться от дискомфорта. Такой метод проверен временем, он получил множество положительных отзывов от пациентов. Главное, соблюдать предельную осторожность при использовании борной кислоты. Чтобы правильно приготовить дезинфицирующий раствор, точно придерживайтесь представленной ниже схемы.
- Купите в аптеке качественную борную кислоту в порошке. Обязательно убедитесь в том, что препарат модно использовать для медицинских целей. Внимательно прочитайте инструкцию и показания к применению на упаковке.
- Подготовьте воду для раствора. Она обязательно должна быть чистая и кипяченая. Лучше использовать слегка теплую жидкость, но не холодную или горячую.
- В глубокой емкости смешайте ингредиенты для раствора. На 300 мл. кипяченой воды добавляйте 1 чайную ложку порошка борной кислоты. Все тщательно перемешайте, убедитесь в том, что вещество полностью растворилось.
Лекарственный дезинфицирующий раствор для глаз готов, можно использовать его по назначению. Хранить готовую жидкость не нужно. Лучше смешивать ингредиенты непосредственно перед применением.
Рекомендации офтальмологов
Если у вас есть какие-либо патологии органов зрения, повреждения слизистой оболочки, применять раствор борной кислоты не рекомендуется. Если вы все же хотите лечиться народными методами, предварительно обязательно нужно проконсультироваться с офтальмологом и убедиться, что это для вас безопасно.
После того, как вы сделали ванночки с борной кислотой, не спешите просушивать глаза. Медики рекомендуют выполнить несколько круговых движений глазами или 2-3 упражнения лечебной гимнастики. Это не только поможет натренировать и оздоровить глазную мышцу, но также будет способствовать равномерному распределению лекарства в глазной впадине.
Сильное воспаление и запущенный конъюнктивит лечить самостоятельно строго запрещено. Взрослый пациент или ребенок с тревожными симптомами (болью, слезотечением, выделениями) должен срочно пройти обследование органов зрения у врача.
bolezniglaz.ru
Борная растворимость в воде - Справочник химика 21
Чистая кислота борная представляет собой жирные на ощупь, бесцветные, прозрачные чешуйчатые кристаллы или мелкий белый кристаллический порошок без запаха. В холодной воде растворяется плохо, в горячей — хорошо Растворима в спирте (1 25) и медленно (1 7) в глицерине. При длительном нагревании до 100 С кислота борная теряет часть воды и переходит в метаборную кислоту. [c.107] Растворимость борной кислоты в 100 мл воды 1,95 г при [c.297]В воде оксиды практически не растворимы за исключением оксида бора (борный ангидрид). [c.444]
Борная кислота хорошо растворима в воде, а также в некоторых органических растворителях. Несмотря на наличие трех гидроксогрупп, в водных растворах она проявляет себя как одноосновная кислота вследствие образования гидроксокомнлекса [c.140]
По-видимому, в растворе образуются и соли орто- и мета-борных кислот, но растворимость тетрабората наименьшая, а сила кислоты Н2В4О7 наибольшая, и равновесие смещено в сторону образования тетрабората. Из воды тетраборат натрия выпадает в виде кристаллогидрата— N326407 ЮН2О (бура). [c.252]
Исследования растворимости в системе борная кпслота — вода —сорбит [c.37]
БУРА (тетраборат натрия) NajBiO, X X IOh3O — соль тетраборной кислоты Н2В4О7, не выделенной в свободном состоянии. В природе Б. встречается в виде минералов, содержится в минеральных и нефтяных водах, в выделениях грязевых вулканов. Б. образует большие бесцветные прозрачные кристаллы, которые на воздухе выветриваются и мутнеют умеренно растворима в воде. Б. получают из борной кислоты, из минералов — тинкаля, кернита и других, а также из воды соляных озер. С оксидами различных металлов Б. образует окрашенные соединения — бораты ( перлы буры ), растворимые в воде, что исполь- [c.48]
К слабым электролитам можно отнести плохо растворимые кислоты (борную, уксусную и др.), а также саму воду. Вода диссоциирует в очень незначительной степени на ионы Н и 01Г. [c.122]
Растворимость борной кислоты в 100 лл воды при О °С — 1,95 г, при 100 С — 39,1 г. В минеральных кислотах растворяется хуже, [c.46]
В воде растворимы только бораты наиболее активных одновалентных металлов. При нейтрали, ации щелочью раствора орто-борной кислоты получается тетраборат, который избытком щелочи может быть переведен в метаборат [c.137]
Откладывая логарифм растворимости по оси ординат, а логарифм диэлектрической проницаемости растворителя по оси абсцисс, получают кривую, подобную изображенной на рис. 10-6 для Ва(10ь)2-Н20 в смесях диоксана с водой. Экспериментальные величины можно сравнить с вычисленными но уравнению Борна и по эмпирическому приближенному расчету, основанному на постоянстве коэффициента активности. В данном случае эмпирический расчет дает вполне хороший результат. [c.364]
Борная кислота — бесцветные, блестяш.не слегка жирные на ощупь чешуйки или мелкий кристаллический порошок без запаха, растворимый в 25 ч. воды, в 3 ч. кипящей воды, в 25 ч. спирта, довольно легко в глицерине. Борная кислота летуча с парами воды или спирта. [c.66]
За счет донорно-акцепторного взаимодействия, о возможности которого упоминалось выше, реакции присоединения вообще характерны для галогенидов бора. Наибольшее значение из соответствующих производных имеет комплексная тетрафторо-борная (иначе борофтористоводородная) кислота Н [ВРц]. Ее кислотные свойства выражены сильнее, чем у НР. Большинство ее солей — фтороборатов — хорошо растворимы в воде. Н[Вр4] устойчива только в растворе и может быть получена пропусканием ВРз через раствор НР в воде [c.253]
Сернокислый магний и сернокислый натрий предназначаются для повышения электропроводности раствора, хлористый натрий — для повышения растворимости никелевого электрода, а борная кислота способствует поддержанию постоянной величины pH. Все компоненты растворяют в горячей воде, и затем раствор фильтруют. [c.245]
Для простых однозарядных неорганических ионов коэффициенты распределения между водой и органической неполярной фазой весьма малы. Так, расчет но уравнению Борна для системы вода —м-гексан (е = 2) при 25° С и радиусе иона 2 А дает значение К 10 [94]. Для более сложных ионов, нанример длинноцепочечных ионов, расчет по формуле Борна неприменим. Их растворимость в органической фазе может быть значительно большей из-за специфических взаимодействий, не учитываемых формулой Борна. Из уравнения (IV.46) видно, что межфазный скачок потенциалов возникает, когда коэффициенты распределения катионов и анионов неодинаковы. В случае малых потенциалов (ф полный скачок потенциалов распределяется между фазами в. отношении [94] [c.134]
Вещества, состоящие из небольших неполярных молекул, например кислород, азот и метан, растворяются в воде примерно в 10 раз хуже, чем в неполярных растворителях. Вещества, состоящие из более крупных неполярных молекул, по существу не растворяются в воде, но, как правило, хорошо растворяются в неполярных растворителях. Вода как бы противодействует включению этих молекул, поскольку образование необходимых для этого пустот сопряжено с разрывом или деформацией водородных связей между молекулами воды. Соединения, подобные бензину и нафталину, не растворяются в воде, поскольку их молекулы в растворе мешали бы молекулам воды образовывать столь же большое число прочных водородных связей, как в чистой воде с другой стороны, борная кислота растворима в воде потому, что уменьшение числа связей между молекулами воды компенсируется образованием прочных водородных связей между молекулами воды и гидроксильными группами молекул борной кислоты. [c.262]
Ее обычно получают из борно-кальциевых или борно-магниевых минералов. Бура представляет собой бесцветные боль шие кристаллы, хорошо растворимые в воде. Раствори буры имеют щелочную реакцию. Бура обладает антисептическими свойствами и весьма широко применяется в косметике. [c.21]
Борная кислота (ортоборная кислота) Н3ВО3 — чешуйчатые бесцветные кристаллы с блеском, т. пл. 169° С растворима в воде. Б. к. относится к слабым кислотам. Встречается в природе В виде минерала сассолина, в горячих источниках и минеральных водах. Б. к. широко известна как дезинфицирующее вещество, применяется также в лабораторной практике для приготовления буферных растворов, в сельском хозяйстве как борное микроудобрение. [c.46]
Для защиты стальных изделий от коррозии в замкнутых охладительных, отопительных системах и водяных системах, работающих на повышенных давлениях и температурах, применяется ингибитор антикор II, представляющий собой комплексное соединение борной кислоты с глюконатом кальция или натрия. Это белый кристаллический порошок, хорошо растворимый в воде. Для защиты от коррозии стальной аппаратуры его вводят в воду в количестве от 0,01 до 0,05 %. [c.98]
Являетея кислотным оксидом. Взаимодействует с водой с образованием борной кислоты (растворима только а горячей воде). [c.309]
Растворимость воды в стеклообраз- ров в ды T щe лoчнo-бt ном борном ангидриде выше, чем в крем- ратных расплавах при 900 неземе и доходит до 0,5 вес.%. и Рн о [c.239]
Бура есть соль, растворимая в воде и способная при нагревании плавиться и преврашаться в стеклообразную массу. Это важное ее свойство, по которому она применяется часто в технике для получения стеклообразных легкоплавких масс, называемых стразами Если буру в жару сплавить, то она сама по себе дает стекло вязкое прозрачное, бесцветное, которое может растворять раз личные окислы. В буре много элементов борной кислоты вода, вероятно, с ними соединена при расплавлении эле менты борной кислоты могут еше растворять окислы получается капелька, застывающая в прозрачное стекло Если это стекло образуется в присутствии окисла, с ко торым соединяется борный ангидрид, то получается сложное стекло. Так как многие основания дают окрашивание, можно получить различно окрашенные стекла от окиси меди получается стекло зеленое, от кобальта —синее стекло. Стразы, таким образом, можно окрашивать в различные цвета. Обыкновенное простое стекло также несколько окрашено. [c.90]
Борный ангидрид при взаимодействии с водой образует ортоборнунэ кислоту. Эта кислота малорастворима в воде, с повышением температуры растворимость ее возрастает. [c.137]
Растворимость борной кислоты Н3ВО3 в воде при 13 С равна 38,5 г в I л раствора и 49,1 г при 20 С. Вычислите термодинамические характеристики процесса растворения. [c.186]
Борная кислота Н3ВО3 растворяется в воде умеренно (при 20°С в 100 г Н2О растворимо 4,9 г h4BQ3). Раствор борной кислоты обладает слабокислой реакцией (/Сд сс = 7,3-10 "). [c.289]
Борная кислота Н3ВО3 —белое кристаллическое полимерное вещество, плохо растворимое в воде. Она очень слабо диссоциирует (рХ=9,24). В щелочном растворе Н3ВО3 дает производные [c.477]
Соли борных кислот —бораты —плохо растворимы в воде (кроме боратов щелочных металлов). Бораты тяжелых металлов окрашены, из расплавов застывают в виде стекол (перлов буры), например СоВ02-2ЫаВ02 (синий перл), ЗМаВОа-Сг(ВОз)з (зеленый перл.). [c.478]
В воде растворимы лишь бораты щелочных металлов. Их растворы сильно гидролизованы и имеют щелочную реакцию. Наиболее важные соединения бора - борная кислота Н3ВО3 и бура Na2B407 10 Н О. [c.60]
Ортоборная кислота — белые шестиугольные кристаллы (чешуйки) триклинной системы, жирные на ощупь. Пл. 1,435 г/см . При нагревании выше 70 С теряет воду и частично переходит в метаборную кислоту НВО2, при температуре красного каления теряет всю воду, оставляя борный ангидрид В Оа. Растворима в воде (4,65% при 20 С), в этиловом спирте (4% при 20 °С), в глицерине (20% при О С, 73% при 100 С) и диэтиловом эфире. Обычная продажная кислота является ортоборной кислотой. [c.164]
Борная (или ортоборная) кислота имеет вид белых, чешуйчатых кристаллов, хорошо растворимых в горячей воде. Чаще всего ее получают действием серной кислоты на тетраборат натрия N33840, + НаЗО + бНаО = 4Н3ВО3 + N32804 [c.310]
Борная кислота Н3ВО3 — бесцветное кристаллическое вещество, хорошо растворимое в горячей воде, [c.371]
Наибольшее практическое значение из соединений бора имеют кислородные соединения. Оксид В2О3 имеет ярко выраженные кислотные свойства при взаимодействии с водой образует ортоборную кислоту Н3ВО3. Орто-борная кислота — белые, чешуйчатые кристаллы, хорошо растворимые в горячей воде. Это очень слабая кислота ( 1 = 6-10- ). [c.171]
Одно из этих правил гласит, что вещество имеет тенденцию растворяться в таких растворителях, которые химически подобны ему. Так, углеводород нафталин СюНв обладает высокой растворимостью в бензине, представляющем собой смесь углеводородов, несколько меньшей растворимостью — в этиловом спирте С2Н5ОН, молекулы которого состоят из коротких углеводородных цепей с гидроксильными группами, и очень плохой растворимостью — в воде, которая сильно отличается от углеводородов. В то же время борная кислота В(ОН)з, являющаяся гидроокисью, обладает умеренной растворимостью в воде и в спирте, т. е. в -веществах, которые содержат гидроксильные группы, и нерастворима в бензине. Три указанных растворителя сами подтверждают то же правило как бензин, так и вода смешиваются со спиртом (растворяются в нем), в то время как бензин и вода взаимно растворяются лишь в очень небольших. количествах. [c.261]
Борная кислота легко образует высококонденсированные кислоты, подобные кремневым кислотам, а боратные стекла по свойствам напоминают силикатное стекло. Стекло пирекс служит для изготовления химической стеклянной и жаростойкой посуды это боралюмосиликатное стекло, содержащее лишь 4% ионов щелочных и щелочноземельных металлов. Такое стекло не обладает свойственной обычному стеклу очень слабой растворимостью в воде, а также имеет меньший коэффициент термического расширения, вследствие чего оно не трескается при резких сменах температур. [c.535]
chem21.info
Борная кислота - это... Что такое Борная кислота?
| Борная кислота | |
 | |
 | |
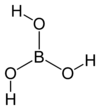 | |
| Систематическое наименование | Ортоборная кислота |
| Химическая формула | h4BO3 |
| Состояние (ст. усл.) | твёрдое |
| Отн. молек. масса | 61,83 а. е. м. |
| Молярная масса | 61,83 г/моль |
| Плотность | 1,435 (15 °C) г/см³ |
| Температура плавления | 170.9 °C, 444 K, 340 °F °C |
| Температура кипения | 300 °C, 573 K, 572 °F °C |
| pKa | 9,24 (I), 12,74 (II), 13,80 (III) |
| Растворимость в воде | 2.52 (0 °C) 4.72 (20 °C)5,74 (25 °C)19.10 (80 °C)27.53 (100 °C) г/100 мл |
| Рег. номер CAS | 10043-35-3 |
| Токсичность |  |
Бо́рная кислота́ (ортоборная кислота) — слабая кислота, имеющая химическую формулу h4BO3.
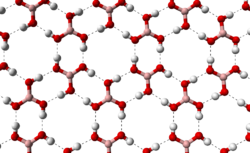
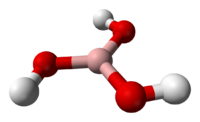
 структура плоского слоя в ортоборной кислоте
структура плоского слоя в ортоборной кислоте Бесцветное кристаллическое вещество в виде чешуек без запаха, имеет слоистую триклинную решетку, в которой молекулы кислоты соединены водородными связями в плоские слои, слои соединены между собой межмолекулярными связями (d= 0,318 нм).
Метаборная кислота (HBO2) также представляет собой бесцветные кристаллы. Она существует в трех модификациях — наиболее устойчивой γ-НВО2 с кубической решеткой, β-НВО2 с моноклинной решеткой и α-НВО2 с ромбической решеткой.
При нагревании ортоборная кислота теряет воду и сначала переходит в метаборную кислоту, затем в тетраборную h3B4O7. При дальнейшем нагревании обезвоживается до борного ангидрида.
Водные растворы борной кислоты являются смесью полиборных кислот общей формулы Н3m-2nВmО3m-n.
Свойства
Борная кислота проявляет очень слабые кислотные свойства. Она сравнительно мало растворима в воде. Ее кислотные свойства обусловлены не отщеплением протона Н+, а присоединением гидроксильного аниона:
![\mathsf{B(OH)_3 + H_2O \rightarrow H[B(OH)_4]}](/800/600/http/dic.academic.ruf1e0960caa8f5645bf2a7555d4637f27.png) Ka = 5.8·10−10 моль/л; pKa = 9.24.
Ka = 5.8·10−10 моль/л; pKa = 9.24. Она легко вытесняется из растворов своих солей большинством других кислот. Соли ее, называемые боратами, производятся обычно от различных полиборных кислот, чаще всего — тетраборной Н2В4О7, которая является значительно более сильной кислотой, чем ортоборная. Очень слабые признаки амфотерности B(OH)3 проявляет, образуя малоустойчивый гидросульфат бора В(HSO4)3.
При нейтрализации ортоборной кислоты щелочами в водных растворах не образуются ортобораты, содержащие ион (ВО3)3−, поскольку ортобораты гидролизуются практически полностью, вследствие слишком малой константы образования [В(ОН)4]−. В растворе образуются тетрабораты, метабораты или соли других полиборных кислот:
 Избытком щелочи они могут быть переведены в метабораты:
Избытком щелочи они могут быть переведены в метабораты: 
Мета- и тетрабораты гидролизуются, но в меньшей степени (реакции, обратные приведенным).
В подкисленных водных растворах боратов устанавливаются следующие равновесия:
![\mathsf{3H[B(OH)_4] \rightleftarrows H^+ + [B_3O_3(OH)_4]^- + 5H_2O}](/800/600/http/dic.academic.ru3b56a45b4b66706284c1d994936cf4c6.png)
![\mathsf{[B_3O_3(OH)_4]^- + OH^- \rightleftarrows [B_3O_3(OH)_5]^{2-} }](/800/600/http/dic.academic.ru139853bd8ddc1eaf13ede6a7870a2d59.png)
Наиболее распространенной солью борной кислоты является декагидрат тетрабората натрия Na2B4O7·10h3O (техническое название — бура).
При нагревании борная кислота растворяет оксиды металлов, образуя соли.
Со спиртами в присутствии концентрированной серной кислоты образует эфиры:

Образование борнометилового эфира В(ОСН3)3 является качественной реакцией на Н3ВО3 и соли борных кислот, при поджигании борнометиловый эфир горит красивым ярко-зеленым пламенем.
Нахождение в природе
В природе свободная борная кислота встречается в виде минерала сассолина, в горячих источниках и минеральных водах.
Применение
См. также
Примечания
Литература
- Карапетьянц М. Х. Дракин С. И. Общая и неорганическая химия. М.: Химия 1994
- Реми Г. «Курс неорганической химии» М.: Иностранная литература, 1963
- Прозоровский. В. КОВАРНАЯ БОРНАЯ КИСЛОТА. Журнал «Наука и жизнь» № 11, 2003 год
dic.academic.ru
Борная кислота
Общие сведения.
Формула:
Н3ВО3
Бо́рная кислота́ (ортоборная кислота)  — слабая кислота.
— слабая кислота.
Бесцветное кристаллическое вещество в виде чешуек без запаха, имеет слоистую триклинную решетку, в которой молекулы  соединены водородными связями в плоские слои, слои соединены между собой межмолекулярными связями (d= 0,318 нм).
соединены водородными связями в плоские слои, слои соединены между собой межмолекулярными связями (d= 0,318 нм).
Метаборная кислота  также предствляет собой бесцветные кристаллы. Она существует в трех модификациях - наиболее устойчивой γ-НВО2 с кубической решеткой, β-НВО2 с моноклинной решеткой и α-НВО2 с ромбической решеткой.
также предствляет собой бесцветные кристаллы. Она существует в трех модификациях - наиболее устойчивой γ-НВО2 с кубической решеткой, β-НВО2 с моноклинной решеткой и α-НВО2 с ромбической решеткой.
При нагревании ортоборная кислота теряет воду и сначала переходит в метаборную кислоту  , затем в тетраборную
, затем в тетраборную  . При дальнейшем нагревании обезвоживается доборного ангидрида.
. При дальнейшем нагревании обезвоживается доборного ангидрида.
Водные растворы борной кислоты являются смесью полиборных кислот общей формулы Н3m-2nВmО3m-n.
Общие
Систематическое наименование: Ортоборная кислота
Молярная масса: 61,83 г/моль
Плотность: 1,435 (15 °С) г/см3
Температура плавления: 170.9 °C, 444 K, 340 °F
Температура кипения: 300 °C, 573 K, 572 °F
Растворимость в воде (г/100мл):
2.52 (0 °C)
4.72 (20 °C) 5,74 (25 °C) 19.10 (80 °C)
27.53 (100 °C)
Получение.
Для получения химически чистой борной кислоты к раствору 1 ч. буры в 4 ч. горячей воды прибавляют столько соляной кислоты, чтобы жидкость сильно окрашивала лакмус в красный цвет; по охлаждении почти вся борная кислота выделяется в виде тонких чешуек, которые отделяют от маточного раствора отжиманием и окончательно очищают перекристаллизацией.
Na2B4O7 + 2НСl+5Н2O=4В (ОН) 3+2NаСl.
Борная кислота кристаллизуется из воды в перламутровых просвечивающих листочках, жирных на ощупь, уд. веса 1, 434 (при 15? Ц.) ; 1 ч. кислоты растворяется в 25, 6 ч. воды при 15 и в 2, 9 ч. кипящей воды; вещество растворимо также в летучих эфирных маслах и в алкоголе, с парами которого летит при нагревании, образуя сложные эфиры; алкогольный раствор свободной кислоты (или солей ее в присутствии серной кислоты) горит зеленым пламенем, что служит для открытия борных соединений (при этом опыте следует избегать медных солей и солей хлористоводородной кислоты, также окрашивающих пламя спирта в зеленый цвет).
Качественный анализ.
Аналитические реакции на борат-ион.
1. С групповым реагентом BaCl2 + CaCl2
2. С куркумовой бумагой (ГФ).
Куркумовая бумага, смоченная раствором тетрабората натрия (или ортоборной кислоты) и несколькими каплями разбавленной хлороводородной кислоты, окрашивается при высушивании в розовый цвет, переходящий в зеленовато-чёрный при дальнейшем смачивании бумаги раствором аммиака. Мешают анионы-окислители, обесцвечивающие куркумовую бумагу.
3. Реакция этерификации с этиловым спиртом в присутствии концентрированной серной кислоты.
Na2B4O7 + h3SO4 + 5 h3O  Na2SO4 + 4 h4BO3
Na2SO4 + 4 h4BO3
h4BO3 + 3 C2H5OH  B(OC2H5)3 + 3 h3O
B(OC2H5)3 + 3 h3O
Методика: 0,2 г борной кислоты (или тетрабората натрия) помещают в фарфоровую чашку. Для дробного открытия выпаривают досуха 1 см3 испытуемого раствора в фарфоровой чашке, прибавляют 1 см3 концентрированной серной кислоты, 3 см3 этанола и перемешивают. При зажигании смесь горит пламенем, окаймленным зелёным цветом. Выполнению реакции мешают хлорид-, бромид-, иодид-ионы. Их удаляют выпариванием с серной кислотой до появления "белого дыма".
Инструментальный анализ.
Электро-химические методы анализа.
ПОТЕНЦИОМЕТРИЧЕСКОЕ ОПРЕДЕЛЕНИЕ ХЛОРОВОДОРОДНОЙ И БОРНОЙ КИСЛОТ ПРИ СОВМЕСТНОМ ПРИСУТСТВИИ
Определение компонентов смеси в растворе основано на дифференцированном титровании их раствором гидроксида натрия с фиксированием двух точек эквивалентности по резкому скачку потенциала. В качестве индикаторного используют стеклянный электрод, электрода сравнения –хлорсеребряный.
Борная кислота является очень слабой кислотой (Кд = 6,4 ´ 10-10 ), поэтому её переводят в более сильную глицероборную кислоту (Кд » 10-7).
Первый скачок титрования соответствует нейтрализации сильной хлороводородной кислоты:
HCl + NaOH = NaCl + Н2О
М HCl = 36,45 г/моль
Затем добавляют глицерин, образуется глицероборная кислота.

Второй скачок титрования соответствует нейтрализации глицероборной кислоты:

М Н3ВО3 = 61,81 г/моль
МЕТОДИКА
2-4 см3 анализируемого раствора (индивидуальное задание) помещают в стакан вместимостью 50 см3 с магнитным стержнем, добавляют дистиллированную воду до объёма, обеспечивающего условия работы.
Бюретку заполняют 0,1 моль/дм3 раствором гидроксида натрия, закрепляют штатив. Стакан с анализируемым раствором устанавливают на столик электромагнитной мешалки, погружают в раствор электроды и приступают к титрованию. Проводят ориентировочное и точное титрования согласно общих указаний. В процессе титрования фиксируют первый скачок титрования, затем к раствору прибавляют 10 см3 глицерина, нейтрализованного по фенолфталеину и продолжают титровать, фиксируя второй скачок титрования по резкому изменению потенциала. Результаты измерений заносят в таблицы.
Расчёт результатов
По интегральному или дифференциальным графикам (по указанию прелодавателя) находят:
объём титранта, соответствующий первому скачку титрования, прореагировавший с хлороводородной кислотой (V1).
объём титранта, соответствующий второму скачку титрования (Voбщ). Тогда: V2 NaOH = (Vобщ – V1) израсходован на титрование Н3ВО3.
Применение.
Борное удобрение
В лабораториях применяют для приготовления буферных растворов
В медицине — как самостоятельное дезинфицирующее средство(Инструкция по приминению). Также на основе борной кислоты производятся различные комбинированные препараты (группа АТХ D08AD), например, паста Теймурова.
В фотографии — в составе мелкозернистых проявителейи кислых фиксажейдля создания слабой кислотной среды.
В быту раньше использовалась для борьбы с тараканами.
В пищевой промышленности — зарегистрирована как пищевая добавкаE284(на территории России эта добавка не входит в список разрешённых к применению[1]).
В игре Новусборной кислотой натирают игровой стол для лучшего скольжения фишек.
На АЭС в качестве поглотителя нейтронов, растворенного в теплоносителе.
Список литературы.
Лурье Ю.Ю. Справочник по аналитической химии. Москва, 1972;
Методическое указание «Инструментальные методы анализа», Пермь, 2004;
Методическое указание «Качественный химический анализ», Пермь, 2003;
Методическое указание «Количественный химический анализ», Пермь, 2004;
Прозоровский. В. КОВАРНАЯ БОРНАЯ КИСЛОТА. Журнал "Наука и жизнь" №11, 2003 год http://www.nkj.ru/archive/articles/3604/;
Рабинович В.А., Хавин З.Я. Краткий химический справочник, Ленинград, 1991;
«Большая советская энциклопедия».
studfiles.net