Подготовка к ЕГЭ по химии. АЛКИНЫ. Алкины вода
Алкины - Электронный учебник K-tree
Алкины - это непредельные углеводороды, имеющие как минимум одну тройную связь. Другое название - ацетиленовые углеводороды, малейшая молекула - ацетилен.

Общая характеристика
Строение
Алкины имеют sp-гибридизацию, поскольку атомы углерода, связанные тройной связью, разделяют три электрона с соседним атомом. Одна из sp-орбиталей перекрывается с орбиталей атома водорода, другая - с соседней sp-орбиталью углерода, образуя одну σ-связь и две перпендикулярные π-связи.
Физические свойства
Из-за низкой полярности, алкены нерастворимы в воде, но хорошо растворимы в органических растворителях, таких как эфир, бензол и тетрахлорметан. В остальном, физические свойства схожи с физическими свойствами алканов и алкенов: температура кипения соответствует температуре кипения алканов и алкенов с равным количеством углеродов. Плотность алкинов чуть выше плотности соответствующих алканов, но меньше чем плотность воды.
Реакции
Гидрирование
Присоединение газообразного водорода происходит с катализаторами Pt, Pd или Ni. В результате реакции образуются алканы. Что бы получить алкены , используют катализатор Линдлара. Катализатор Линдлара - это палладий, нанесённый на карбонат кальция и обработанный солью свинца или серы. С катализатором Линдлара образуются только цис-алкены (Z). Ещё один способ - порошок натрия в жидком аммиаке, в результате образуются алкены транс.
Гидрирование в алканы
В присутствии катализатора Pt, Pd или Ni: Ch4-C≡C-Ch4 (2-бутин) + h3 → Ch4-Ch3-Ch3-Ch4 (бутан)Гидрирование в алкены
В присутствии катализатора Линдлара: Ch4-C≡C-Ch4 (2-бутин) + h3 → Ch4-CH=CH-Ch4 (цис-2-бутен)Гидрирование в аммиаке с натрием
В присутствии жидкого аммиака и натрия: Ch4-C≡C-Ch4 → Ch4-C•=C••Na-Ch4 → Ch4-C•=CH-Ch4 → Ch4-C••Na=CH-Ch4 → Ch4-CH=CH-Ch4 (транс-2-бутен)Галогенирование
Реакция галогенирования происходит в два этапа: сначала образуется дигалогеналкен, который, в свою очередь, реагируя с избытком галогенов образует тетрагалогеналкан.
CH≡CH + Br2 (ацетилен) → CHBr=CHBr + Br2 (дибромэтен) → CHBr2-CHBr2 (тетрабромэтан)Присоединение галогенводородов
Галогенводороды легко присоединяются к тройной связи, формируя галогеналкилы. Галогенводороды смешивают с уксусной кислотой, либо напрямую, в газообразном состоянии, смешивают. Для рассмотрения механизма реакции, необходимо иметь знать правило Марковникова.
Механизм реакции присоединения галогенводородов такой же, как и у алкенов: происходит гомолитический разрыв связи в молекуле галогенводорода, образовывается протон и анион галогена. Протон присоединяется к алкину образуя карбкатион, такая реакция является эндотермической и имеет высокий уровень энергии активации, поэтому реакция происходит медленно. Образованный карбкатион очень реактивен, поэтому легко связывается с галогеном, энергия активации низкая, поэтому этот этап не тормозит реакцию.
Полимеризация
Полимеризация алкинов происходит в присутствии катализатора, которым может быть водный раствор CuCl2 и Nh5Cl. В результате реакции образуется винилацетилен, который обладает высокой реакционной способностью. При пропускании ацетилена над активированным углем при температуре 600 °С образуется бензол.
Получение
Алкины очень редко встречаются в природе, но были обнаружены в атмосфере Урана, Юпитера и Сатурна. В промышленности используют несколько способов получения, например, прокаливанием в печах смеси оксида кальция с коксом при температуре 1800—2000°С, с последующей обработкой водой. Другой способ - пиролиз метана. В лаборатории, как правило, получают гидролизом карбида кальция.
Применение алкинов
Ввиду малой распространённости алкинов на земле, широкое применение нашёл только ацетилен, из которого синтезируют:
- растворители тетрахлорэтан и трихлорэтилен
- хлоропреновые, бутадиеновые и синтетические каучуки
- полиакриламид, который используют для очистки питьевой воды
- уретановые полимеры (основа - тетрагидрофуран)
- Пластик ПВХ
- Клей ПВА
- ацетальдегид, из которого синтезируют уксусную кислоту, бутадиен и другие вещества
Автор статьи: Телятников Захар Александрович Дата редакции статьи: 03.09.2017
k-tree.ru
Алкины. Свойства. Применение | Учеба-Легко.РФ
Алкины. Алкинами называются ненасыщенные углеводороды, молекулы которых содержат одну тройную связь. Общая формула алкинов СnН2n-2.
По номенклатуре ИЮПАК наличие тройной связи в молекуле обозначается суффиксом -ин, который заменяет суффикс-ан в названии соответствующего алкана.
Структурная изомерия алкинов, как и алкенов, обусловлена строением углеродной цепи и положением в ней тройной связи.
Физические свойства. По физическим свойствам алкины напоминают алканы и алкены. Низшие алкины C2—C4представляют собой газы, С5—C16 — жидкости, высшие алкины — твердые вещества. Температуры кипения алкинов несколько выше, чем у соответствующих алкенов.
Способы получения. 1. Общим способом получения алкинов является реакция дегидрогалогенирования -отщепления двух молекул галогеноводорода от дигалогензамещенных алканов, которые содержат два атома галогена либо у соседних атомов углерода (например, 1,2-дибромпропан), либо у одного атома углерода (2,2-дибромпропан). Реакция происходит под действием спиртового раствора гидроксида калия:
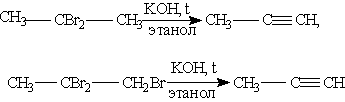 2. Важнейший из алкинов — ацетилен — получают в промышленности путем высокотемпературного крекинга метана:
2. Важнейший из алкинов — ацетилен — получают в промышленности путем высокотемпературного крекинга метана:
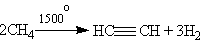 В лаборатории ацетилен можно получить гидролизом карбида кальция:
В лаборатории ацетилен можно получить гидролизом карбида кальция:
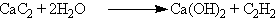
Химические свойства. Тройная связь образуется двумя атомами углерода в sp-гибридном состоянии. Две s -связи расположены под углом 180°, а две p -связи расположены во взаимно перпендикулярных областях. Наличие p -связей обусловливает способность алкинов вступать в реакции электрофильного присоединения. Однако эти реакции для алкинов протекают медленнее, чем для алкенов. Это объясняется тем, что p -электронная плотность тройной связи расположена более комплексно, чем в алкенах, и поэтому менее доступна для взаимодействия с различными реагентами.
1. Галогенирование. Галогены присоединяются к алкинам в две стадии. Например, присоединение брома к ацетилену приводит к образованию дибромэтена, который, в свою очередь, реагирует с избытком брома с образованием тетрабромэтана:
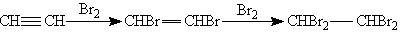 2. Гидрогалогенирование. Галогеноводороды присоединяются к тройной связи труднее, чем к двойной. Для активации галогеноводорода используют АlСl3 — сильную кислоту Льюиса. Из ацетилена при этом можно получить винилхлорид (хлорэтен), который используется для получения важного полимера — поливинилхлорида;
2. Гидрогалогенирование. Галогеноводороды присоединяются к тройной связи труднее, чем к двойной. Для активации галогеноводорода используют АlСl3 — сильную кислоту Льюиса. Из ацетилена при этом можно получить винилхлорид (хлорэтен), который используется для получения важного полимера — поливинилхлорида;
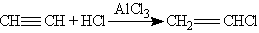 3. Гидратация. Присоединение воды к алкинам катализируется солями ртути (П) (реакция Кучерова):
3. Гидратация. Присоединение воды к алкинам катализируется солями ртути (П) (реакция Кучерова):
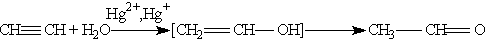
На первой стадии реакции образуется непредельный спирт, в котором гидроксогруппа находится непосредственно у атома углерода при двойной связи. Такие спирты принято называть виниловыми или енолами.
Отличительной чертой большинства енолов является их неустойчивость. В момент образования они изомеризуются в более стабильные карбонильные соединения (альдегиды или кетоны) за счет переноса протона от гидроксильной группы к соседнему атому углерода при двойной связи. При этом p -связь между атомами углерода разрывается и образуется p -связь между атомом углерода и атомом кислорода. Причиной изомеризации является большая прочность двойной связи С == О по сравнению с двойной связью С == С.
В результате реакции гидратации только ацетилен превращается в альдегид, гидратация гомологов ацетилена протекает по правилу Марковникова, и образующиеся енолы изомеризуются в кетоны. Так, пропин превращается в ацетон:
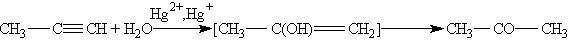
4. Кислотные свойства. Особенностью алкинов, имеющих концевую тройную связь, является их способность отщеплять протон под действием сильных оснований, т, е, проявлять слабые кислотные свойства. Возможность отщепления протона обусловлена сильной поляризацией s -связи º С¬ Н. Причиной поляризации является высокая электроотрицательность атома углерода в sp-гибридном состоянии. Поэтому алкины, в отличие от алкенов и алканов, способны образовывать соли, называемые ацетиленидами.
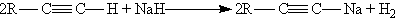 Ацетилениды серебра и меди (I) легко образуются и выпадают в осадок при пропускании ацетилена через аммиачный раствор оксида серебра или хлорида меди (I). Эта реакция служит для обнаружения алкинов с тройной связью на конце цепи:
Ацетилениды серебра и меди (I) легко образуются и выпадают в осадок при пропускании ацетилена через аммиачный раствор оксида серебра или хлорида меди (I). Эта реакция служит для обнаружения алкинов с тройной связью на конце цепи:
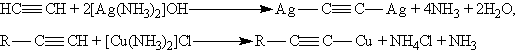
Ацетилениды серебра и меди как соли очень слабых кислот легко разлагаются при действии хлороводородной кислоты с выделением исходного алкина:
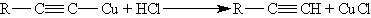 Таким образом, используя реакции образования и разложения ацетиленидов, можно выделять алкины из смесей с другими углеводородами.
Таким образом, используя реакции образования и разложения ацетиленидов, можно выделять алкины из смесей с другими углеводородами.
5. Полимеризация. В присутствии катализаторов алкины могут реагировать друг с другом, причем в зависимости от условий образуются различные продукты. Так, под действием водного раствора CuCl и Nh5Cl ацетилен димеризуется, давая винилацетилен:
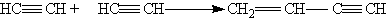 Винилацетилен обладает большой реакционноспособностью; присоединяя хлороводород, он образует хлоропрен, используемый для получения искусственного каучука:
Винилацетилен обладает большой реакционноспособностью; присоединяя хлороводород, он образует хлоропрен, используемый для получения искусственного каучука:
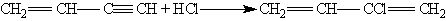 При пропускании ацетилена над активированным углем при 600 °С происходит тримеризация ацетилена с образованием бензола:
При пропускании ацетилена над активированным углем при 600 °С происходит тримеризация ацетилена с образованием бензола:
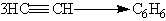 6. Реакции окисления и восстановления. Алкины окисляются различными окислителями, в частности перманганатом калия. При этом раствор перманганата калия обесцвечивается, что служит указанием на наличие тройной связи. При окислении обычно происходит расщепление тройной связи и образуются карбоновые кислоты:
6. Реакции окисления и восстановления. Алкины окисляются различными окислителями, в частности перманганатом калия. При этом раствор перманганата калия обесцвечивается, что служит указанием на наличие тройной связи. При окислении обычно происходит расщепление тройной связи и образуются карбоновые кислоты:
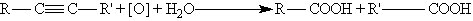 В присутствии металлических катализаторов алкины восстанавливаются путем последовательного присоединения молекул водорода, превращаясь сначала в алкены, а затем в алканы:
В присутствии металлических катализаторов алкины восстанавливаются путем последовательного присоединения молекул водорода, превращаясь сначала в алкены, а затем в алканы:
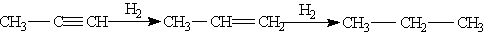
Применение. Ацетилен применяется в качестве исходного сырья для многих промышленных химических синтезов. Из него получают уксусную кислоту, синтетический каучук, поливинилхлоридные смолы. Тетрахлорэтан СНСl2—CHCl2 — продукт присоединения хлора к этилену — служит хорошим растворителем жиров и многих органических веществ и, что очень важно, безопасен в пожарном отношении. Ацетилен используют для автогенной сварки металлов.
uclg.ru
Органическая химия: алкины
Алкины (ацетиленовые углеводороды) – непредельные алифатические углеводороды, молекулы которых содержат тройную связь C≡C.
Тройную связь C≡C осуществляют 6 общих электронов:

В образовании такой связи участвуют атомы углерода в sp-гибридизованном состоянии. Каждый из них имеет по две sp-гибридных орбитали и две негибридных р-орбитали
Общая формула: Сnh3n-2
Окончание: -ин
Гомологический ряд:
C2h3 этин или ацетилен (даже чаще используется)C3h5 пропинC4H6 бутинC5H8 пентин
Номенклатура:
По систематической номенклатуре названия ацетиленовых углеводородов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса –ан на –ин:
2 атома С → этан → этин; 3 атома С → пропан → пропин и т.д.- Главная цепь выбирается таким образом, чтобы она обязательно включала в себя тройную связь (т.е. она может быть не самой длинной)(так же как у алкенов).
- Нумерацию углеродных атомов начинают с ближнего к тройной связи конца цепи. Цифра, обозначающая положение тройной связи, ставится обычно после суффикса –ин. Например:

Изомерия алкинов
Структурная изомерия- Изомерия положения тройной связи (начиная с С4Н6):

- Изомерия углеродного скелета (начиная с С5Н8):

Межклассовая изомерия с алкадиенами и циклоалкенами, начиная с С4Н6:

Пространственная изомерия относительно тройной связи в алкинах не проявляется, т.к. заместители могут располагаться только одним способом – вдоль линии связи.
Химические свойства алкинов сходны с алкенами, что обусловлено их ненасыщенностью.
Реакции присоединения к алкинам
1. Гидрирование
В присутствии металлических катализаторов (Pt, Ni) алкины присоединяют водород с образованием алкенов (разрывается первая π-связь), а затем алканов (разрывается втораяπ-связь):

2. Галогенирование
 Алкины обесцвечивают бромную воду (качественная реакция). Вот как это выглядит:
Алкины обесцвечивают бромную воду (качественная реакция). Вот как это выглядит:
3. Гидрогалогенирование
Продукты присоединения к несимметричным алкинам определяются правилом Марковникова:
Гидрохлорирование ацетилена используется в одном из промышленных способов получения винилхлорида:
 Радикал СН2=СН- называется винил, название этого радикала очень часто встречается в тестах ЕГЭ
Радикал СН2=СН- называется винил, название этого радикала очень часто встречается в тестах ЕГЭВинилхлорид является исходным веществом (мономером) в производстве поливинилхлорида (ПВХ).
4. Гидратация (реакция Кучерова)Присоединение воды происходит в присутствии катализатора соли ртути (II) и идет через образование неустойчивого непредельного спирта, который изомеризуется в уксусный альдегид (в случае ацетилена):
 или в кетон (в случае других алкинов):
или в кетон (в случае других алкинов): 5. Полимеризация 1. Димеризация под действием водно-аммиачного раствора CuCl:
5. Полимеризация 1. Димеризация под действием водно-аммиачного раствора CuCl: 
2. Тримеризация ацетилена над активированным углем приводит к образованию бензола (реакция Зелинского):


Есть такое интересное высокомолекулярное вещество – карбин (одна из аллотропных модификаций углерода) – образуется не в результате полимеризации ацетилена, а при окислительной поликонденсации ацетилена в присутствии CuCl:
 _________________________________________________________________________________ Есть одна реакция, которая нечасто встречается в учебниках, но часто в тестах ГИА и ЕГЭ:образование ацетиленида серебра:
_________________________________________________________________________________ Есть одна реакция, которая нечасто встречается в учебниках, но часто в тестах ГИА и ЕГЭ:образование ацетиленида серебра: 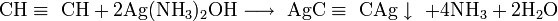
осадок - белого цвета
Ацетиленид меди: RC≡CCu - красный осадок
Эти две реакции - качественные на тройную связь
_________________________________________________________________________________
Окисление алкинов



Получение алкинов:
Получение ацетилена:
Пиролиз метана:

Пиролиз этана или этилена:

Гидролиз карбида кальция:
 или
или 
Получение других алкинов:
 2) удлинение цепи (алкилирование ацетиленидов) при действии на ацетилениды алкилгалогенидами
2) удлинение цепи (алкилирование ацетиленидов) при действии на ацетилениды алкилгалогенидами
organichimik.blogspot.ru
Алкины: получение, применение, свойства
Сегодня алкины имеют немаловажное значение в различных сферах деятельности человека. Но и столетие назад получение большинства органических соединений начиналось именно с ацетилена. Длилось это до тех пор, пока основным источником сырья для химического синтеза не стала нефть.
Из этого класса соединений в современном мире получают всевозможные пластмассы, каучуки, синтетические волокна. В больших объемах из ацетилена производят уксусную кислоту. Автогенная сварка является важным этапом машиностроения, возведения зданий и сооружений, прокладывания коммуникаций. Всем известный клей ПВА получают из ацетилена с промежуточной стадией образования винилацетата. Также он является отправной точкой в синтезе этанола, используемого в качестве растворителя и для парфюмерной промышленности.

Алкины представляют собой углеводороды, в молекулах которых содержится тройная углерод-углеродная связь. Их общая химическая формула - СnН2n-2. Простейший алкин в соответствии с правилами систематической номенклатуры называется этином, но более распространено его тривиальное название - ацетилен.
Природа связи и физические свойства
Ацетилен имеет линейное строение, причем все связи в нем намного короче, чем в этилене. Объясняется это тем, что для образования σ-связи используются sp-гибридные орбитали. Образуется тройная связь из одной σ-связи и двух π-связей. Пространство между атомами углерода имеет высокую электронную плотность, которая стягивает их ядра с положительным зарядом и увеличивает энергию разрыва тройной связи.
Н―С≡С―Н
В гомологическом ряду ацетилена первые два вещества являются газами, следующие соединения, содержащие от 4 до 16 атомов углерода - жидкости, а далее идут алкины в твердом агрегатном состоянии. По мере возрастания молекулярной массы увеличиваются температуры плавления и кипения ацетиленовых углеводородов.

Получение алкинов из карбида
Этот метод нередко используют в промышленности. Ацетилен образуется при смешивании карбида кальция и воды:
СаС2 + 2Н20 → ΗС≡СΗ + Са(ОΗ)2
При этом наблюдается выделение пузырьков получаемого газа. В ходе реакции можно ощутить специфический запах, но он не имеет отношения к ацетилену. Причиной его являются примеси Ca3P2 и CaS в карбиде. Ацетилен также получают по аналогичной реакции из карбидов бария и стронция (SrC2, ВаС2). А из карбида магния можно получить пропилен:
MgC2 + 4Н2О → СН3―С≡СН + 2Mg(ОН)2
Синтез ацетилена
Эти методы не годятся для других алкинов. Получение ацетилена из простых веществ возможно при температуре выше 3000 °С по реакции:
2С + Н2 → НС≡СН
Фактически реакция осуществляется в электрической дуге меж угольных электродов в атмосфере водорода.
Однако этот способ имеет только научное значение. В промышленности же ацетилен часто получают пиролизом метана или этана:
2СН4 → НС≡СН + 3Н2
СΗ3―СΗ3 → СΗ≡СΗ + 2Н2
Пиролиз обычно проводят при очень высоких температурах. Так, метан нагревают до 1500 °С. Специфичность этого способа получения алкина заключается в необходимости быстрого охлаждения продуктов реакции. Это связано с тем, что при таких температурах ацетилен сам может распадаться на водород и углерод.
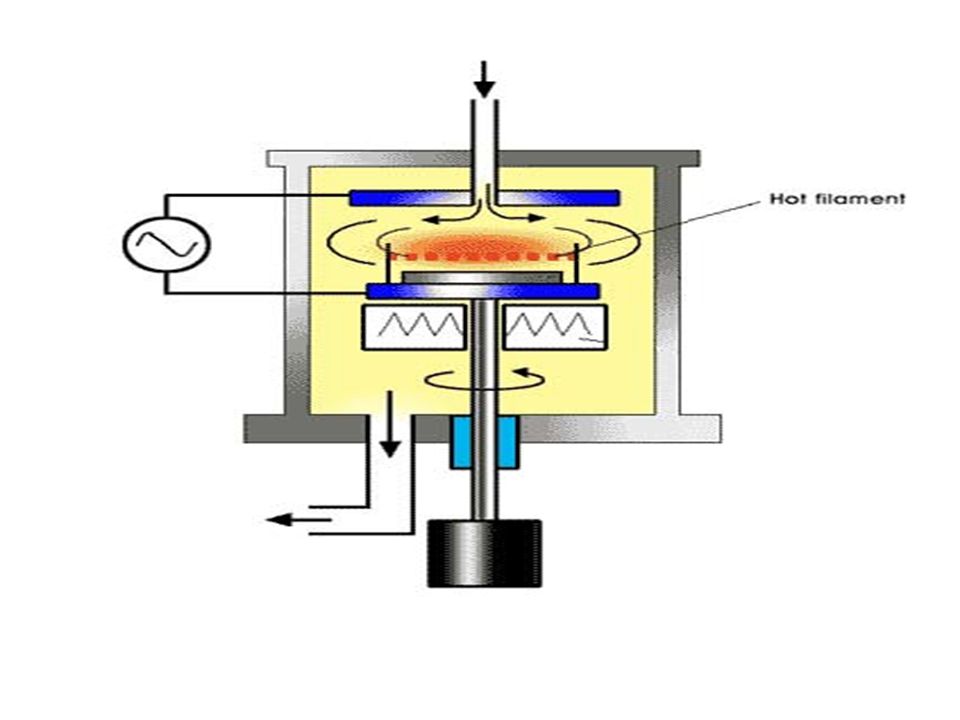
Получение алкинов дегидрогалогенированием
Как правило, проводится реакция отщепления двух молекул HBr или HCl от дигалогеналканов. Обязательным условием является связанность галогена либо с соседними атомами углерода, либо с одним и тем же. Если не отражать промежуточных продуктов, реакция примет вид:
СΗ3―CHBr―СΗ2Br → СΗ3―С≡СΗ + 2HBr
СΗ3―СΗ2―CBr2―СΗ3 → СΗ3―С≡С―СН3 + 2НВ
Этим способом возможно получение алкинов из алкенов, но предварительно их галогенируют:
СΗ3―СΗ2―СΗ=СΗ2 + Br2 → СΗ3―СΗ2―CHBr―СΗ2Br → СΗ3―СΗ2―С≡СΗ + 2HBr
Удлинение цепи
Этот способ может одновременно продемонстрировать получение и применение алкинов, поскольку исходным веществом и продуктом этой реакции являются гомологи ацетилена. Осуществляется по схеме:
R―С≡С―Η → R―С≡С―Μ + R’―Х → R―С≡С―R’ + ΜХ
Промежуточной стадией является синтез солей алкинов - ацетиленидов металлов. Чтобы получить ацетиленид натрия, на этин нужно подействовать металлическим натрием или его амидом:
НС≡СН + NaNh3 → НС=С―Na + Nh4
Чтобы образовался алкин, полученная соль должна прореагировать с галогеналканом:
НС≡С―Na + Br―СΗ2―СΗ3 → СΗ3―С≡С―СΗ2―СΗ3 + NaBr
НС≡С―Na + Cl―СΗ3 → СΗ3―С≡С―СΗ3 + NaCl
Способы получения алкинов не исчерпываются данным перечнем, однако именно приведенные выше реакции имеют наибольшее производственное и теоретическое значение.

Реакции электрофильного присоединения
Химические свойства ацетиленовых углеводородов объясняются наличием π-электронной плотности тройной связи, которая подвергается действию электрофильных частиц. Из-за того что связь С≡С очень короткая, этим частицам сложнее взаимодействовать с алкинами, чем в аналогичных реакциях алкенов. Этим объясняется и меньшая скорость присоединения.
Галогенирование. Присоединение галогенов происходит в две стадии. На первом этапе образуется дигалогензамещенный алкен, а затем тетрагалогензамещенный алкан. Так, при бромировании ацетилена получается 1,1,2,2-тетрабромэтан:
СΗ≡СΗ + Br2 → CHBr=CHBr
CHBr=CHBr + Br2 → CHBr2―CHBr2
Гидрогалогенирование. Протекание данных реакций подчиняется правилу Марковникова. Чаще всего конечный продукт реакции имеет два атома галогена, соединенных с одним и тем же углеродом:
СΗ3―С≡СΗ + HBr → СΗ3―CBr=СΗ2
СΗ3―CBr=СΗ2 + HBr → СΗ3―CBr2―СΗ3
То же касается и алкенов с неконцевой тройной связью:
СΗ3―СΗ2―С≡С―СΗ3 + HBr → СΗ3―СΗ2―CBr=СΗ―СΗ3
СΗ3―СΗ2―CBr=СΗ―СΗ3 + HBr → СΗ3―СΗ2―CBr2―СΗ2―СΗ3
Фактически в реакциях подобных алкинов получение чистых веществ возможно не всегда, поскольку параллельно идет реакция, в которой присоединение галогена осуществляется к другому атому углерода при тройной связи:
СΗ3―СΗ2―С≡С―СΗ3 + HBr → СН3―СΗ2―СΗ2―CBr2―СΗ3
В данном примере получается смесь из 2.2-дибромпентана и 3,3-дибромпентана.
Гидратация. Это очень важное химическое свойство алкинов. И получение в ее ходе различных карбонильных соединений имеет большое значение в химической промышленности. Реакция носит имя своего открывателя, российского химика М. Г. Кучерова. Присоединение воды возможно в присутствии h3SO4 и HgSO4.
Из ацетилена получают уксусный альдегид:
ΗС≡СΗ + Η2О → СΗ3―СОΗ
Гомологи ацетилена участвуют в реакции с образованием кетонов, поскольку присоединение воды идет подчиняясь правилу Марковникова:
СΗ3―С≡СΗ + Η2О → СΗ3―СО―СΗ3
Кислотные свойства алкинов
Ацетиленовые углеводороды с тройной связью на конце цепи способны отщеплять протон под влиянием сильных окислителей, например щелочей. Получение натриевых солей алкинов уже рассматривалось выше.
Ацетилениды серебра и меди широко применяют для выделения алкинов из смеси с другими углеводородами. В основе этого процесса лежит их способность выпадать в осадок во время пропускания алкина сквозь аммиачный раствор оксида серебра или хлорида меди:
СН≡СН + 2Ag(Nh4)2ОН → Ag―С≡С―Ag + Nh4 + 2Н2О
R―С≡СН + Cu(Nh4)2ОН → R―С≡С―Cu + 2Nh4 + Н2О

Реакция окисления и восстановления. Горение
Алкины легко поддаются окислению раствором перманганата калия, при этом происходит его обесцвечивание. Одновременно с разрушением тройной связи идет образование карбоновых кислот:
R―С≡С―R’ → R―СООН + R’―СООН
Восстановление алкинов идет путем последовательного присоединения двух молекул водорода в присутствии платины, палладия или никеля:
СΗ3―С≡СΗ + Η2 → СΗ3―СΗ=СΗ2
СΗ3―СΗ―СΗ2 + Η2 → СΗ3―СΗ2―СΗ3
Применение ацетилена также связано с его способностью выделять огромное количество теплоты при горении:
2С2Η2 + 5О2 → 4СО2 + 2Η2О + 1309,6 кДж/моль
Получаемой при этом температуры хватает для расплавления металлов, что и используется в ацетиленовой сварке и резке металлов.

Полимеризация
Не менее важно свойство ацетилена в особых условиях образовывать ди-, три- и полимеры. Так, в водном растворе хлоридов меди и аммония образуется димер – винилацетилен:
ΗС≡СΗ + ΗС≡СΗ → Η2С=СΗ―С≡СΗ
Который, в свою очередь, вступая в реакции гидрохлорирования, образует хлоропрен – сырье для искусственного каучука.
При температуре 600 °С над активированным углем ацетилен тримеризуется с образованием не менее ценного соединения – бензола:
3С2Н2 → С6Н6

По результатам последнего времени объемы применения алкинов несколько снизились за счет замещения их нефтепродуктами, однако во многих отраслях они также продолжают занимать лидирующие позиции. Таким образом, ацетилен и прочие алкины, свойства, применение и получение которых подробно рассмотрены нами выше, еще долгое время будут важным звеном не только в научных исследованиях, но и в жизни простых людей.
fb.ru
Урок 20. Алкины – HIMI4KA

Определение. Гомологический ряд, номенклатура, изомерия
Алкины — это нециклические углеводороды, в молекулах которых есть одна тройная связь, а остальные связи простые.
Алкины относят к группе непредельных ненасыщенных углеводородов. Для того чтобы вывести общую формулу гомологического ряда алкинов, сравним состав алканов и алкинов:
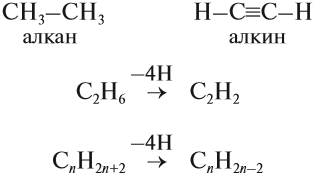
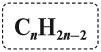
Таким образом, алкины образуют гомологический ряд, общая формула которого
Вопрос. Какие ещё углеводороды имеют такую же общую формулу гомологического ряда?
Значит, алкины и алкадиены с одинаковым числом атомов углерода являются изомерами.
Первый член гомологического ряда С2Н2 называется ацетилен. Поэтому алкины относятся к ацетиленовым углеводородам.
Вопрос. Почему в названиях ацетиленовых углеводородов появился суффикс ИН? (См. урок 17.7.)
Задание 20.1. Составьте молекулярную и графическую формулы алкина с n = 4.
Выполнив последнее задание, вы убедитесь, что для этого алкина можно составить две графические формулы:

Значит, изомерия алкинов связана с положением тройной связи в молекуле. Кроме того, изомерия связана со строением углеводородного радикала:
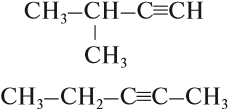
Задание 20.2. Составьте молекулярные формулы этих соединений и убедитесь, что это изомеры. Назовите эти вещества.
Запомните:
- названия алкинов составляют, используя суффикс ИН;
- нумерацию основной цепи ведут с того конца, к которому ближе тройная связь.


Строение молекул
В состав молекулы любого алкина входит одна тройная связь, поэтому особенности свойств этих соединений будут связаны с особенностями тройной связи. Это сложная, неоднородная связь. Её составляют одна простая σ-связь и две π-связи.
Вопрос. Какая из этих связей легче разрушается в химических реакциях? Почему?
Значит, как и у алкенов, в химических реакциях будет прежде всего разрушаться менее прочная π-связь. Алкины тоже легко вступают в химические реакции, но, в отличие от алкенов, большинство реакций за счёт π-связи идут в две стадии: сначала разрывается одна π-связь, потом вторая π-связь. Характерной реакцией является реакций присоединения, хотя возможны и другие типы реакций.


Свойства алкинов
Физические свойства
По физическим свойствам алкины мало отличаются от алкенов и алканов. Так, простейший алкин ацетилен — газ без вкуса и запаха, плохо растворимый в воде. Среди гомологов ацетилена есть и жидкие, и твёрдые вещества: чем больше молекулярная масса, тем выше температуры кипения и плавления алкинов.
Химические свойства
Для алкинов, как и для алкенов, характерны реакции присоединения. Они идут в две стадии:
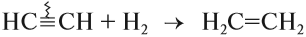
Вопрос. Возможна ли для полученного соединения реакция присоединения?
Поскольку полученный этилен содержит двойную связь, возможна вторая стадия этого процесса:
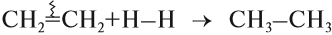
Вопрос. Возможна ли реакция присоединения для полученного вещества? Почему?
Таким образом, в результате реакции гидрирования из ацетилена можно получить и этилен, и этан. Всё зависит от условия процесса и от соотношения исходных веществ. Например, реакцию присоединения хлороводорода к ацетилену часто прерывают на первой стадии:
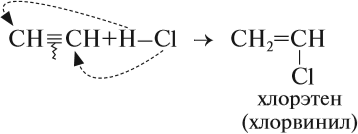
Дело в том, что хлорвинил применяется для получения полимера полихлорвинила.
Задание 20.3. Составьте уравнения реакции полимеризации хлорвинила.
Изделия из полихлорвинила (–СНСl–СН2–)n имеют разнообразное применение.
Так, полихлорвинил (ПХВ, или ПВХ) является основой для получения искусственной кожи, различной посуды одноразового пользования, полимерной тары, клеёнок, отделочных материалов и т. д. Многие пластмассовые изделия, которые мы используем каждый день, обивка салонов автомобилей, вагонов, самолётов, — сделаны из ПВХ. Он также используется для электроизоляции проводов.
Аналогично идут и другие реакции присоединения. Например, ацетилен, как и этилен, обесцвечивает бромную воду. Кроме того, он обесцвечивает и раствор перманганата калия, т. е. вступает в реакции окисления.
Задание 20.4. Составьте уравнения реакции ацетилена с бромом.
Таким образом, ацетилен тоже даёт качественные реакции на π-связь. Поэтому правильнее говорить, что реакции обесцвечивания бромной воды и перманганата калия — это качественные реакции на кратную связь. Другими словами, при помощи этих реакций можно обнаружить непредельные соединения, содержащие кратную связь, которая содержит π-связь.
Большое практическое значение имеет реакция присоединения воды к ацетилену — гидратация ацетилена. Поскольку эту реакцию открыл и изучил российский ученый М. Г. Кучеров*, она носит название «реакция Кучерова»:
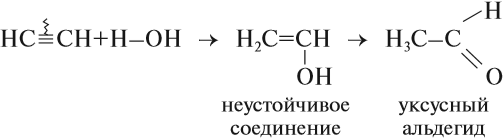
* Кучеров Михаил Григорьевич (3.06.1850–26.06.1911) — русский химик-органик. Открыл (1881) реакцию каталитической гидратации ацетиленовых углеводородов с образованием карбонилсодержащих соединений.
Уксусный альдегид нужен для получения уксусной кислоты. Ацетилен горит.
Задание 20.5. Составьте уравнение реакции горения ацетилена.
Газообразные углеводороды можно различить по характеру пламени. Так, метан горит бесцветным пламенем, этилен — светящимся, а ацетилен — коптящим, т. е. углерод окисляется не полностью и частично выделяется в виде простого вещества (сажи). В токе кислорода ацетилен горит ослепительно-голубым пламенем с выделением большого количества теплоты (температура пламени превышает 3000 °C!). Поэтому эта реакция используется для газовой сварки и резки металлов.
При неполном окислении ацетилена (раствором перманганата калия) образуется смесь кислот.
Для ацетилена возможна реакция полимеризации, причём в эту реакцию может вступать небольшое число молекул. Так, при тримеризации ацетилена (соединяются три молекулы) образуется циклическое соединение — бензол:
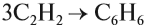
Для алкинов характерна подвижность атомов водорода у тройной связи. За счёт этих атомов происходят реакции замещения таких атомов водорода:
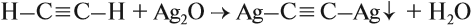
Аналогичная реакция замещения происходит и с оксидом меди (I), и со щелочными металлами. В результате обеих реакций выделяется осадок, поэтому их считают качественными реакциями на алкины, в молекулах которых имеется атом водорода у тройной связи. Такая же реакция замещения происходит и со щелочными металлами.


Получение и применение ацетилена
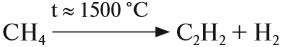
Ацетилен в небольших количествах входит в состав природных газов. Его получают крекингом метана:
В небольших количествах, например для сварки металлов и в лаборатории, его получают из карбида кальция:
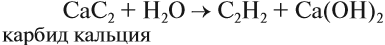
Ацетилен, полученный карбидным способом, используется для сварки и резки металлов, поскольку температура пламени автогена (горение ацетилена в кислороде) достигает 3000 °C.
Ацетилен и его производные используются для получения пластмасс, каучуков, уксусной кислоты, растворителей.


Выводы
Алкины — это непредельные углеводороды, содержащие тройную связь. Для таких веществ характерны реакции:
- присоединения;
- окисления;
- полимеризации. Все они происходят за счёт разрыва π-связи, которая входит в состав тройной связи;
- замещения атома водорода у тройной связи.
Урок 20. Алкины
4 (80%) 4 voteshimi4ka.ru
Подготовка к ЕГЭ по химии. АЛКИНЫ.
АЛКИНЫ -углеводороды, содержащие в молекуле одну ТРОЙНУЮ связь.
Общая формула алкинов: Cnh3n-2
Тройная связь является комбинацией из одной σ- и двух π-связей, образуемых двумя sp-гибридизованными атомами углерода. σ-Cвязи, образуемые sp-гибридными орбиталями углерода, располагаются на одной прямой (под углом 1800 друг к другу).
Поэтому молекула ацетилена имеет линейное строение:

Номенклатура алкинов.
Первый член гомологического ряда – этин имеет историческое название:
НС≡СН ацетилен.
По систематической номенклатуре названия ацетиленовых углеводородов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса –ан на –ин:
H-C≡C-H - этИН СН3-С≡С-Н – пропИН и т.д.
Главная цепь выбирается таким образом, чтобы она обязательно включала в себя тройную связь (т.е. она может быть не самой длинной).
Виды изомерии алкинов.
1.Изомерия положения тройной связи (начиная с С4Н6):
HC≡C-Ch3-Ch4 h4C-C≡C-Ch4
бутин-1 бутин-2
2.Изомерия углеродного скелета (начиная с С5Н8):
НС≡С-СН2-СН2-СН3 НС≡С-СН-СН3
∣
СН3
3.Межклассовая изомерия с алкадиенами ( начиная с С3Н4) и циклоалкенами (начиная с С4Н6):
HC≡C-Ch3-Ch4 СН2=СН-СН=СН2 СН=СН
бутин-1 бутадиен ∣ ∣ циклобутен
СН2-СН2
ПОЛУЧЕНИЕ АЛКИНОВ.
1.Пиролиз метана:
2СН4-(1500ºС) C2h3 + 3h3
Реакцию проводят электродуговым способом, пропуская метан между электродами с временем контакта 0,1-0,01 секунды. Столь малое время нагревания обусловлено тем, что ацетилен при такой температуре может разлагаться на углерод и водород.
2.Гидролиз карбида кальция:
СаО + С -(t) СаС2 + СО
СаС2 + Н2О Са(ОН)2 + С2Н2
Карбид кальция образуется при нагревании оксида кальция СаО (жженой извести) и кокса до 2500ºС. При дальнейшем гидролизе выделяется ацетилен.
3. Дегидрогалогенирование дигалогеналканов спиртовым раствором щелочи (щелочь и спирт берутся в избытке).
R-Ch3-CBr2-R + 2KOH -(спирт) R-C≡C-R + 2h3O + 2 KBr
R-CHBr-CHBr-R + 2KOH -(спирт) R-C≡C-R + 2h3O + 2 KBr
4. Удлинение цепи (алкилирование ацетиленидов) при действии на ацетилениды алкилгалогенидами.
R-C≡CNa + Br-R' R-C≡C-R' + NaBr
СВОЙСТВА АЛКИНОВ
Особенности алкинов:
π-Электроны более короткой тройной связи прочнее удерживаются ядрами атомов углерода и обладают меньшей поляризуемостью (подвижностью).
Поэтому реакции ЭЛЕКТРОФИЛЬНОГО ПРИСОЕДИНЕНИЯ к алкинам протекают медленнее, чем к алкенам.
Алкины с концевой тройной связью (алкины-1) проявляют КИСЛОТНЫЕ СВОЙСТВА и способны, вступая в реакции с активными металлами, образовывать соли.
1. Реакции присоединения.
А. Гидрирование:
В присутствии металлических катализаторов (Pt, Ni) алкины присоединяют водород с образованием алкенов (разрывается первая π-связь), а затем алканов (разрывается вторая π-связь):

При использовании менее активного катализатора [Pd/CaCO3/Pb(Ch4COO)2] гидрирование останавливается на стадии образования алкенов.
Б. Галогенирование:
Электрофильное присоединение галогенов к алкинам протекает медленнее, чем для алкенов (первая π-связь разрывается труднее, чем вторая):
Алкины обесцвечивают бромную воду (качественная реакция).

В. Гидрогалогенирование.
Присоединение галогеноводородов также идет по электрофильному механизму. Продукты присоединения к несимметричным алкинам определяются правилом Марковникова:

Г. Гидратация (реакция Кучерова):
Присоединение воды в присутствии катализатора соли ртути (II) идет через образование неустойчивого енола, который изомеризуется в альдегид или кетон.
Если гидратации подвергается АЦЕТИЛЕН, то образуется уксусный альдегид.

Из всех остальных алкинов при гидратации образуются кетоны (так как присоединение протекает по правилу Марковникова).

2. Димеризация и тримеризация алкинов.
1) Димеризация под действием водно-аммиачного раствора CuCl:

2) Тримеризация ацетилена над активированным углем приводит к образованию бензола (реакция Зелинского):

3. Кислотные свойства алкинов с концевой тройной связью.
Образование солей: концевые атомы водорода у ацетилена и алкинов-1 могут замещаться атомами металла. При этом образуются соли – ацетилениды:
СН3-С≡С-Н + NaNh3 СН3-С≡С-Na + Nh4
амид натрия ацетиленид натрия
При взаимодействии ацетилена (или R–C≡C–H) с аммиачными растворами оксида серебра или хлорида меди (I) выпадают осадки нерастворимых ацетиленидов:

HC≡CH + 2[Cu(Nh4)2]OH CuC≡CCu + 4Nh4 + 2h3O
Образование серовато-белого осадка ацетиленида серебра (или красно-коричневого - ацетиленида меди) служит качественной реакцией на концевую тройную связь.
AgC≡CAg + Н2О – реакция не идет
AgC≡CAg + 2НСl НC≡CН + 2АgCl
Окисление алкинов:
Алкины обесцвечивают раствор KMnO4, что используется для их качественного определения.
1) Ацетилен окисляется раствором перманганата калия до соли щавелевой кислоты – оксалата калия (в нейтральной среде) или до щавелевой кислоты (кислая среда):
3НС≡СН + 8KMnO4 + 4h3O 3НООС-СООН + 8MnO2↓+ 8KOH
щавелевая кислота
3НС≡СН + 8KMnO4 2K2C2O4 + 8MnO2 ↓+ 2KOH + 2h3O
оксалат калия
2) Алкины окисляются перманганатом калия с расщеплением тройной связи и образованием карбоновых кислот:
5С2Н2 + 8KMnO4 + 12Н2SО4 5НООС-СООН + 8MnSO4 + 4K2SO4 + 12h3O
5R-C≡СН + 8KMnO4 + 12Н2SО4 5R-СООН + 5CO2 + 8MnSO4 + 4K2SO4 + 12h3O
5R-C≡С-R1 + 6KMnO4 + 9Н2SО4 5R-СООН + 5R1-COOH +6MnSO4 +3K2SO4 + 4h3O
www.metod-kopilka.ru
Лекция №
Лекция №15
АЛКИНЫ
План.
- Изомеризация и номенклатура.
- Методы синтеза.
- Структура и физические свойства.
- Химические свойства.
Алкины – углеводороды ациклического ряда, содержащие в своей структуре два атома углерода, связанные между собой тремя связями, а оставшиеся валентности этих атомов могут быть затрачены на образование связей с другими атомами углерода или атомами водорода.
Алкины образуют гомологический ряд соединений, выраженных общей формулой Сnh3n-2. Первый член гомологического ряда – этин или ацетилен.
Изомерия и номенклатура
Согласно IUPAC названия алкинов образуют, заменяя в названиях алканов суффикс “-ан” на “-ин”. В качестве родоначальной структуры выбирают самую длинную цепь, содержащую тройную связь. Нумерацию этой цепи начинают с того конца, к которому ближе находится тройная связь.
Примеры

Названия остатков алкинов образуют, присоединяя суффикс –ил к названию алкина:
HCº C- этинил
СН3-Сº С- пропинил-1
НСº С-СН2- пропинил-2.
В рациональной номенклатуре замещенные алкины рассматриваются как производные ацетилена:

Структурная изомерия начинается с 4-го “С”, изомерия, связанная с изомерией углеродного скелета начиная с 5 “С”. По числу изомеров ацетиленовые углеводороды занимают промежуточное положение между алканами и алкенами.
Методы синтеза алкинов
- Реакции пиролиза метана или этана
2Ch5 C2h3
+ 3h3
C2h3
+ 3h3
Ch4 -
Ch4 C2h3 + 2h3
C2h3 + 2h3
При пиролизе метана необходимо строго выдерживать время реакции. Для этого используется “закалка” - быстрый ввод на выходе реакционной зоны воды.
- Карбидный метод
CaC2 + 2h3O ® C2h3 + Ca(OH)2 Аналогично реагируют карбиды стронция и бария SrC2, BaC2. Карбид магния с водой образует пропин
Mg2C3 +4 h3O ® Ch4C º CH + 2Mg(OH)2
- Реакции нуклеофильного отщепления дигалогеналканов и моногалогеналкенов.
Ch4-CHBr-Ch3Br
+ 2NaOH  Ch4-Cº CH + 2NaBr + 2h3O
Ch4-Cº CH + 2NaBr + 2h3O
Ch4-BrC=Ch3 + NaOH  Ch4-Cº CH + NaBr + h3O
Ch4-Cº CH + NaBr + h3O
- Алкилирование алкинов.
Реакции проводятся через синтез ацетиленидов
а) R-Cº CH + NaNh3® R-Cº C-Na+ + Nh4
R-Cº CNa + R'Hal ® RCº CR' + NaHal
б) R-Cº C-H +Ch4-MgHal ® R-Cº C-MgHal + Ch5
R-Cº C-MgHal + R’Hal ® R-Cº C-R’ + MgHal2
Физические свойства алкинов и природа связей
Алкины представляют собой бесцветные газы или жидкости. Начиная с С17 , алкины являются кристаллическими веществами.
Тройная связь представляет собой одну s -связь С-С и две p -связи. При переходе от двойной к тройной связи средняя энергия p -связи снижается. Это означает, что тройная связь менее стабильна, чем двойная. Сам ацетилен неустойчивое соединение и способен к спонтанному взрывному распаду на элементы. Молекула ацетилена имеет линейное строение, что обусловлено sp-состоянием атомов углерода. Тройная связь в алкинах характеризуется более высокой поляризуемостью, чем в алкенах RCº C = 5,96; RC=C=4,17.
По сравнению с алкенами алкины характеризуются большими значениями потенциалов ионизации. Это означает, что электрон на ВЗМО у ацетилена связан прочнее чем у этилена. Это обусловливает более высокую электрофильность алкенов по сравнению с алкинами. Потенциал ионизации алкинов резко снижается при введении в них алкильных групп.
В электронных спектрах поглощения алкины имеют полосу поглощения при 170-180 нм, что соответствует p - p * - переходу. В ИК спектрах характерны валентные колебания связи Сº С при 2100-2260 см-1 и связи º С-Н при 3270-3330 см-1.
В спектрах ПМР химический сдвиг атома водорода º С-Н равен 1,7-2 м.д.
Химические свойства алкинов.
Высокая степень ненасыщенности алкинов обусловливает их склонность к реакциям присоединения. В реакциях электрофильного присоединения алкины менее реакционноспособны по сравнению с алкенами, несмотря на то что энергия p -связей у последних выше. Это обусловлено более высокой электрофильностью алкенов. В то же время в реакциях, имеющих гомолитический характер, например, каталитическое гидрирование, большую реакционную способность обнаруживают алкены.
- Реакция гидрирования.
Реакция имеет ступенчатый характер:

Сat: металлические Ni, Pl, Pd.
На первой стадии количественно образуется алкен, и после практического исчерпывания алкина начинается гидрирование алкена. Это связано с более высоким сродством алкинов к поверхности катализатора. Обычно реакция протекает нестереоселективно и образуется смесь цис- и транс-продуктов присоединения.
Модификация катализаторов приводит к стереоселективному синтезу. Так, промотируя палладий оксидом свинца (II) и CaCO3, получают катализатор Линдлара, на котором осуществляется стереоспецифичный синтез цис-изомера.
|
RCºCR' + 2h3 |
® |
RCH=CHR' |
|
|
|
цис-алкен |
К аналогичным результатам приводит катализатор Pd/BaSO4 в пиридине.
Стереоселективное восстановление тройной связи можно осуществлять, используя для этого соответствующие агенты. К этим реакциям относятся:
а) восстановление натрием или литием в жидком аммиаке или этиламине. При этом преимущественно образуется транс-изомер:

б) Гидроборирование. Алкины, подобно алкена, реагируют с гидридами бора, присоединяя их по тройной связи углерод-углерод

Первоначально образуется моноалкенильное производное бора, причем присоединение идет против правила Марковникова. Дальнейшее присоединение может происходить по двойной связи моноалкенильных производных бора. Однако если R2BH ( или RBh3) содержит объемные группы, то пространственные препятствия затрудняют вторую реакцию присоединения и достигается высокий выход моноалкенильного производного.
Реакции такого типа особенно важны для синтезов, поскольку моноалкенильные производные бора могут быть окислены щелочным раствором Н2О2 в альдегиды (если в исходном алкине тройная связь находиться на конце цепи) или в кетоны ( если тройная связь неконцевая)
2C4H9CºCH + R4B2h3® 2C4H9CH=CHB(R)2 2C4H9CH=CH-OH
®
2C4H9CH=CH-OH
®
® 2C4H9Ch3CHO

Моноалкенильные производные бора легко реагируют с уксусной кислотой в мягких условиях, образуя алкены. Весь этот процесс полностью стереоспецифичен, поскольку дизамещенные алкины дают только цис-алкены. Очевидно, что гидрид бора присоединяется к тройной связи цис-способом и образующийся моноалкенил бора реагирует далее с кислотой, образуя цис-алкен.

Реакции электрофильного присоединения.
- Присоединение галогенов (Cl2 и Br2)
Алкины, подобно алкенам, участвуют в реакциях присоединительного галогенирования. Отличие состоит лишь в том, что алкин можен присоединить две молекулы галогена, а алкен – только одну:

Промежуточный дигалогенид может быть получен присоединением одной молекулы галогена к алкину при низких температурах, причем реакция протекает преимущественно как транс-присоединение.
Реакции присоединения галогенов к алкинам как и другие реакции электрофильного присоединения, происходят медленнее, чем реакции присоединения к алкенам.
HCº C-Ch3-CH=Ch3 HCº C-Ch3-CHBr-Ch3Br
(90%)
HCº C-Ch3-CHBr-Ch3Br
(90%)
Такое соотношение реакционных способностей связано с различием устойчивости карбкатионов, образующихся при присоединении электрофильного реагента к кратным связям

Можно видеть, что винил-катион менее устойчив по сравнению с алкил-катионом, поэтому образование последнего характеризуется более низким энергетическим барьером. В целом механизм галогенирования алкина (на примере бромирования) может быть представлен следующими стадиями:

2. Присоединение галогеноводородов к алкинам.
Присоединение хлоро- и бромоводорода к алкинам протекает также, как и к алкенам. Реакция имеет ступенчатый характер.

Обе реакции идут по правилу Марковникова. Показано, что присоединение галогеноводородов к алкинам идет как транс-присоединение. Поскольку реакционная способность тройной связи меньше чем у алкенов, используют катализ: например HgCl2.

3. Реакция гидратации (Реакция Кучерова)

Механизм этой реакции можно представить последовательностью стадий:

При синтезе ацетальдегида протекают побочные реакции:
а) альдольная конденсация
Ch4CHO+Ch4CHO  Ch4CH(OH)Ch3CHO
Ch4CH(OH)Ch3CHO  Ch4CH=CH-CHO
Ch4CH=CH-CHO  альдегидные
смолы
альдегидные
смолы
б) окисление
Сh4CHO + 2Hg2+ 2Hg+
+ Ch4COOH + 2H+
2Hg+
+ Ch4COOH + 2H+
Ch4CHO
+ Hg+ Hg + Ch4COOH
+ 2H+
Hg + Ch4COOH
+ 2H+
Подавление приведенных побочных реакций можно обеспечить путем увеличения скорости подачи ацетилена в реакционную зону. Благодаря этому образующийся альдегид отдувается из реакционной массы и степень его вовлечения в побочные реакции резко снижается.
4. Присоединение HCN.

5. Присоединение спиртов.

Кислотные свойства ацетилена и алкинов
с терминальной тройной связью.
Соединения этого типа являются С-Н – кислотами. Атом водорода, находящийся при углероде тройной связи обладает большей кислотностью, чем атом водорода алкенов и алканов. Объясняется это тем, что атомы Сº обладают большим s-характером и поэтому сильнее притягивают электроны, поэтому С-Н связи поляризованы и электроположительные атомы водорода в них проявляют большую кислотность. Кислотность ацетилена и a -алкинов проявляется в следующих реакциях:
RCº CH + K+Nh3-
 RCº C-K+ + Nh4
RCº C-K+ + Nh4
Амид-анион обладает высокой основностью, что обусловливает сдвиг равновесия в сторону образования ацетиленида. В то же время, вода, обладая более высокой кислотностью по сравнению с ацетиленом, вытесняет последний из ацетиленидов:
RCº CК + h3O® RCº CH + КOH
Натриевые, калиевые и другие ацетилениды щелочных металлов являются истинными солями, состоящие из катиона металла и ацетиленид-анионов. Соли ацетиленов с тяжелыми металлами (Ag, Cu, Hg) – не в полном смысле соли. Это ковалентно-построенные соединения, нерастворимые в воде. Они осаждаются из водного раствора.
Осаждением ацетиленида серебра определяют наличие тройной связи или отделяют терминальные ацетилены от дизамещенных:
RCº CH + [Ag(Nh4)2]NO3® RCº CAg + Nh5NO3 + Nh4
RCº CR' + [Ag(Nh4)2]NO3 ® реакция не идет
Монозамещенные ацетилены тяжелых металлов легко регенерируют из осадка под действием сильных минеральных кислот.
RCº CAg + HNO3® RCº CH + AgNO3
Аналогичное использование находят ацетилениды меди
RCºCH + [Cu(Nh4)2]Cl ® RCºC-Cu¯ + Nh5Cl + Nh4
RCºC-Cu + HCl ® RCºCH + CuCl
Ацетилениды магния (реактив ) имеют важное синтетическое значение. Их получают действием терминального алкина на магний органические соединения с предельными радикалами:
RCºCH + Ch4MgI ® Ch5 + RCºC-MgI
Благодаря этому реактиву можно получать спирты и карбоновые кислоты, содержащую тройную связь: а) RCºC-MgI + Ch3=O ® RCºC-Ch3-OMgI  RCºC-Ch3OH + Mg(OH)I
RCºC-Ch3OH + Mg(OH)I
первичный спирт
б)

вторичный спирт
в)

третичный спирт
г) 
карбоновая кислота
Подобные синтезы можно осуществлять путем конденсации ацетилена или терминальных алкинов с альдегидами и кетонами (Фаворский)

Механизм:

+ OH-
Конденсация ацетилена с альдегидами в присутствии щелочей не дает желаемого результата из-за побочной реакции альдольной конденсации. В.Реппе осуществил ее разработав новый катализатор на основе ацетиленида меди, стабилизированного соединениями висмута:
СHº CH + Ch3O ® CHº CH-Ch3OH  HO-Ch3-Cº C-Ch3-OH
HO-Ch3-Cº C-Ch3-OH
(бутиндиол-1,4)
Изомеризация алкинов
Алкины способны к изомеризации с перемещением кратной связи или с превращением в диеновые углеводороды.
Под действие щелочных металлов тройная связь переходит на конец молекулы полученного ацетиленида. Действие спиртовых щелочей способствует переходу тройной связи с конца молекулы в центр. Промежуточными продуктами в этих превращениях являются алленовые углеводороды (Фаворский)
Ch4Ch3CºCH  Ch4CºCCh4
Ch4CºCCh4
Окисление
RCº CR' + KMnO4  RCOOH
+ R'COOH
RCOOH
+ R'COOH
RCºCH  RCOOH + CO2
RCOOH + CO2
RCºCR'  RCOOH + R'COOH
RCOOH + R'COOH
Окислительная конденсация терминальных алкинов.
2RCºCH  RCºC-CºCR
RCºC-CºCR
Полимеризация
1) Реакция Зелинского:

2) Димеризация:
2HCºCH HCºC-CH=Ch3
HCºC-CH=Ch3 h3C=CH-CºC-CH=Ch3
h3C=CH-CºC-CH=Ch3
винилацетилен дивинилацетилен Карбонилирование (Реппе)
CHºCH + CO + h3O ® Ch3=CH-COOH акриловая кислота
CHºCH + CO + ROH ® Ch3=CH-COOR эфир акриловой кислоты
CHºCH + CO + Nh4® Ch3=CH-CONh3 амид акриловой кислоты
Катализаторами этих реакций являются карбонилы никеля и кобальта.
trotted.narod.ru


















