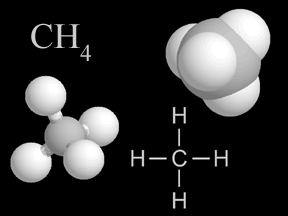
Алканы — номенклатура, получение, химические свойства. Алкан вода
общие сведения. Физические и химические свойства алканов :: SYL.ru
Предельные углеводороды – это такие соединения, которые представляют собой молекулы, состоящие из атомов углерода, находящихся в состоянии гибридизации sp3. Они связаны между собой исключительно ковалентными сигма-связями. Название «предельные» или «насыщенные» углеводороды исходит из того факта, что эти соединения не имеют возможности присоединять какие-либо атомы. Они предельны, полностью насыщены. Исключение составляют циклоалканы.
Что такое алканы?
Алканы – это углеводороды предельные, а их углеродная цепь незамкнута и состоит из атомов углерода, связанных между собой при помощи одинарных связей. Она не содержит иных (то есть двойных, как у алкенов, или же тройных, как у алкилов) связей. Алканы также называют парафинами. Это название они получили, так как общеизвестные парафины являются смесью преимущественно данных предельных углеводородов С18-С35 с особой инертностью.
Общие сведения об алканах и их радикалах
Их формула: СnР2n+2, здесь n больше или равно 1. Молярная масса вычисляется по формуле: М = 14n + 2. Характерная особенность: окончания в их названиях - «-ан». Остатки их молекул, которые образуются в результате замещения водородных атомов на иные атомы, имеют название алифатических радикалов, или алкилов. Их обозначают буквой R. Общая формула одновалентных алифатических радикалов: СnР2n+1, здесь n больше или равно 1. Молярная масса алифатических радикалов вычисляется по формуле: М = 14n + 1. Характерная особенность алифатических радикалов: окончания в названиях «-ил». Молекулы алканов имеют свои особенности строения:
- связь С-С характеризуется длиной 0,154 нм;
- связь С-Н характеризуется длиной 0,109 нм;
- валентный угол (угол между связями углерод-углерод) равен 109 градусов и 28 минут.
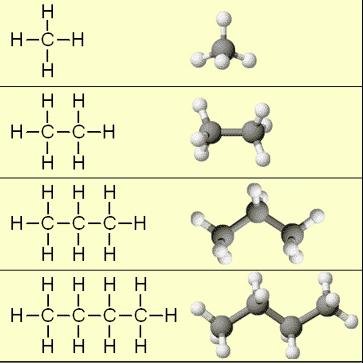
Начинают гомологический ряд алканы: метан, этан, пропан, бутан и так далее.
Физические свойства алканов
Алканы – это вещества, которые не имеют цвета и нерастворимы в воде. Температура, при которой алканы начинают плавиться, и температура, при которой они закипают, повышаются в соответствии с увеличением молекулярной массы и длины углеводородной цепи. От менее разветвленных к более разветвленным алканам температуры кипения и плавления понижаются. Газообразные алканы способны гореть бледно-голубым либо бесцветным пламенем, при этом выделяется довольно много тепла. СН4-С4Н10 представляют собой газы, у которых отсутствует также и запах. С5Н12-С15Н32 – это жидкости, которые обладают специфическим запахом. С15Н32 и так далее – это твердые вещества, которые также не имеют запаха.
Химические свойства алканов
Данные соединения являются малоактивными в химическом плане, что можно объяснить прочностью трудноразрываемых сигма-связей - С-С и С-Н. Также стоит учитывать, что связи С-С неполярны, а С-Н малополярны. Это малополяризуемые виды связей, относящиеся к сигма-виду и, соответственно, разрываться по наибольшей вероятности они станут по механизму гомолитическому, в результате чего будут образовываться радикалы. Таким образом, химические свойства алканов в основном ограничиваются реакциями радикального замещения.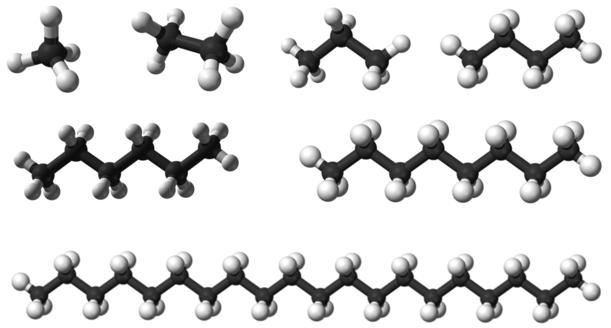
Реакции нитрования
Алканы взаимодействуют только с азотной кислотой с концентрацией 10% либо с оксидом четырехвалентного азота в газовой среде при температуре 140°С. Реакция нитрования алканов носит название реакции Коновалова. В результате образуются нитросоединения и вода: Ch5 + азотная кислота (разбавленная) = Ch4 – NO2 (нитрометан) + вода.
Реакции горения
Предельные углеводороды очень часто применяются как топливо, что обосновано их способностью к горению: СnР2n+2 + ((3n+1)/2) O2 = (n+1) h3O + n СО2.
Реакции окисления
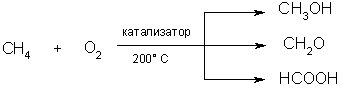
В химические свойства алканов также входит их способность к окислению. В зависимости от того, какие условия сопровождают реакцию и как их изменяют, можно из одного и того же вещества получить различные конечные продукты. Мягкое окисление метана кислородом при наличии катализатора, ускоряющего реакцию, и температуры около 200 °С может дать в результате следующие вещества:
1) 2СН4 (окисление кислородом) = 2СН3ОН (спирт – метанол).
2) СН4 (окисление кислородом) = СН2О (альдегид – метаналь или формальдегид) + Н2О.
3) 2СН4 (окисление кислородом) = 2НСООН (карбоновая кислота – метановая или муравьиная) + 2Н2О.

Также окисление алканов может производиться в газообразной или жидкой среде воздухом. Такие реакции приводят к образованию высших жирных спиртов и соответствующих кислот.
Отношение к нагреванию
При температурах, не превышающих +150-250°С, обязательно в присутствии катализатора, происходит структурная перестройка органических веществ, которая заключается в изменении порядка соединения атомов. Данный процесс называется изомеризацией, а вещества, полученные в результате реакции – изомерами. Таким образом, из нормального бутана получается его изомер - изобутан. При температурах 300-600°С и наличии катализатора происходит разрыв связей С-Н с образованием молекул водорода (реакции дегидрирования), молекул водорода с замыканием углеродной цепи в цикл (реакции циклизации или ароматизации алканов):
1) 2СН4 = С2Н4 (этен) + 2Н2.
2) 2СН4 = С2Н2 (этин) + 3Н2.
3) С7Н16 (нормальный гептан) = С6Н5 – СН3 (толуол) + 4Н2.
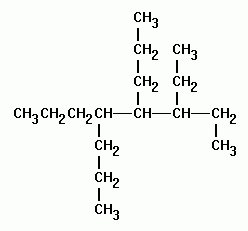
Реакции галогенирования
Такие реакции заключаются во введении в молекулу органического вещества галогенов (их атомов), в результате чего образуется связь С-галоген. При взаимодействии алканов с галогенами образуются галогенпроизводные. Данная реакция обладает специфическими особенностями. Она протекает по механизму радикальному, и чтобы ее проинициировать, необходимо на смесь галогенов и алканов воздействовать ультрафиолетовым излучением или же просто нагреть ее. Свойства алканов позволяют реакции галогенирования протекать, пока не будет достигнуто полное замещение на атомы галогена. То есть хлорирование метана не закончится одной стадией и получением метилхлорида. Реакция пойдет далее, будут образовываться все возможные продукты замещения, начиная с хлорметана и заканчивая тетрахлорметаном. Воздействие хлора при данных условиях на другие алканы приведет к образованию различных продуктов, полученных в результате замещения водорода у различных атомов углерода. От температуры, при которой идет реакция, будет зависеть соотношение конечных продуктов и скорость их образования. Чем длиннее углеводородная цепь алкана, тем легче будет идти данная реакция. При галогенировании сначала будет замещаться атом углерода наименее гидрированый (третичный). Первичный вступит в реакцию после всех остальных. Реакция галогенирования будет происходить поэтапно. На первом этапе заместиться только один атом водорода. C растворами галогенов (хлорной и бромной водой) алканы не взаимодействуют.
Реакции сульфохлорирования
Химические свойства алканов также дополняются реакцией сульфохлорирования (она носит название реакции Рида). При воздействии ультрафиолетового излучения алканы способны реагировать со смесью хлора и диоксида серы. В результате образуется хлороводород, а также алкильный радикал, который присоединяет к себе диоксид серы. В результате получается сложное соединение, которое становится стабильным благодаря захвату атома хлора и разрушения очередной его молекулы: R–H + SO2 + Cl2 + ультрафиолетовое излучение = R–SO2Cl + HCl. Образовавшиеся в результате реакции сульфонилхлориды находят широкое применение в производстве поверхностно-активных веществ.
www.syl.ru
Физические и химические свойства алканов
Алканы образуют гомологический ряд, каждое химическое соединение которого по составу отличается от последующего и предыдущего на одинаковое число атомов углерода и водорода – Ch3, а вещества, входящие в гомологический ряд, называются гомологами. Гомологический ряд алканов представлен в таблице 1.
Таблица 1. Гомологический ряд алканов.
|
Метан |
Ch5 |
|
Этан |
C2H6 |
|
Пропан |
C3H8 |
|
Бутан |
C4h20 |
|
Пентан |
C5h22 |
|
Гексан |
C6h24 |
|
Гептан |
C7h26 |
|
Октан |
C8h28 |
|
Нонан |
C9h30 |
|
Декан |
C10h32 |
В молекулах алканов выделяют первичные (т.е. связанные одной связью), вторичные (т.е. связанные двумя связями), третичные (т.е. связанные тремя связями) и четвертичные (т.е. связанные четырьмя связями) атомы углерода.
C1h4 – C2h3 – C1h4 (1 – первичные, 2- вторичные атомы углерода)
Ch4 –C3H(Ch4) – Ch4 (3- третичный атом углерода)
Ch4 – C4(Ch4)3 – Ch4 (4- четвертичный атом углерода)
Для алканов характерна структурная изомерия (изомерия углеродного скелета). Так, у пентана имеются следующие изомеры:
Ch4-Ch3-Ch3-Ch3-Ch4 (пентан)
Ch4 –CH(Ch4)-Ch3-Ch4 (2-метилбутан)
Ch4-C(Ch4)2-Ch4 (2,2 – диметилпропан)
Для алканов, начиная с гептана, характерна оптическая изомерия.
Атомы углерода в предельных углеводородах находятся в sp3 –гибридизации. Углы между связями в молекулах алканов 109,5 .
.
Химические свойства алканов
При обычных условиях алканы химически инертны — не реагируют ни с кислотами, ни со щелочами. Это объясняется высокой прочностью  -связей С-С и С-Н. Неполярные связи С-С и С-Н способны расщепляться только гомолитически под действием активных свободных радикалов. Поэтому алканы вступают в реакции, протекающие по механизму радикального замещения. При радикальных реакция в первую очередь замещаются атомы водорода у третичных, затем у вторичных и первичных атомов углерода.
-связей С-С и С-Н. Неполярные связи С-С и С-Н способны расщепляться только гомолитически под действием активных свободных радикалов. Поэтому алканы вступают в реакции, протекающие по механизму радикального замещения. При радикальных реакция в первую очередь замещаются атомы водорода у третичных, затем у вторичных и первичных атомов углерода.
Реакции радикального замещения имеют цепной характер. Основные стадии: зарождение (инициирование) цепи (1) – происходит под действием УФ-излучения и приводит к образованию свободных радикалов, рост цепи (2) – происходит за счет отрыва атома водорода от молекулы алкана; обрыв цепи (3) – происходит при столкновении двух одинаковых или разных радикалов.
X:X → 2X. (1)
R:H + X. → HX + R. (2)
R. + X:X → R:X + X. (2)
R. + R. → R:R (3)
R. + X. → R:X (3)
X. + X. → X:X (3)
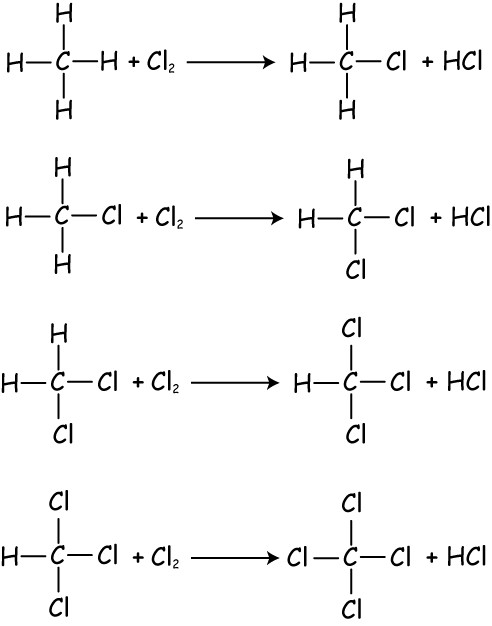
Галогенирование. При взаимодействии алканов с хлором и бромом при действии УФ-излучения или высокой температуры образуется смесь продуктов от моно- до полигалогензамещенных алканов:
Ch5 + Cl2 = Ch4Cl + HCl (хлорметан)
Ch4Cl +Cl2 = Ch3Cl2 + HCl (дихлорметан)
Ch3Cl2 +Cl2 = CHCl3 + HCl (трихлорметан)
CHCl3 +Cl2 = CCl4 + HCl (тетрахлорметан)
Нитрование (реакция Коновалова)
. При действии разбавленной азотной кислоты на алканы при 140 С и небольшом давлении протекает радикальная реакция:
С и небольшом давлении протекает радикальная реакция:
Ch4-Ch4 +HNO3 = Ch4-Ch3-NO2 (нитроэтан) + h3O
Сульфохлорирование и сульфоокисление. Прямое сульфирование алканов протекает с трудом и чаще всего сопровождается окислением, в результате чего образуются алкансульфонилхлориды:
R-H + SO2 + Cl2 → R-SO3Cl + HCl
Реакция сульфоокисления протекает аналогично, только в этом случае образуются алкансульфоновые кислоты:
R-H + SO2 + ½ O2 → R-SO3H
Крекинг – радикальный разрыв связей С-С. Протекает при нагревании и в присутствии катализаторов. При крекинге высших алканов образуются алкены, при крекинге метана и этана образуется ацетилен:
С8h28 = C4h20 (бутан)+ C3H8 (пропан)
2Ch5 = C2h3 (ацетилен) + 3h3↑
Окисление. При мягком окислении метана кислородом воздуха могут быть получены метанол, муравьиный альдегид или муравьиная кислота. На воздухе алканы сгорают до углекислого газа и воды:
Cnh3n+2 + (3n+1)/2 O2 = nCO2 + (n+1)h3O
Физические свойства алканов
При обычных условиях С1-С4 – газы, С5-С17 – жидкости, начиная с С18 – твердые вещества. Алканы практически нерастворимы в воде, но, хорошо растворимы в неполярных растворителях, например, в бензоле. Так, метан СН4 (болотный, рудничий газ) – газ без цвета и запаха, хорошо растворимый в этаноле, эфире, углеводородах, но плохо растворимый в воде. Метан используют в качестве высококалорийного топлива в составе природного газа, в качестве сырья для производства водорода, ацетилена, хлороформа и других органических веществ в промышленных масштабах.
Пропан С3Н8 и бутан С4Н10 – газы, применяемые в быту, в качестве балонных газов, за счет легкой сжижаемости. Пропан используется в качестве автомобильного топлива, поскольку является более экологически чистым, чем бензин. Бутан – сырье для получения 1,3 –бутадиена, использующегося в производстве синтетического каучука.
Получение алканов
Алканы получают из природных источников – природного газа (80-90% — метан, 2-3% — этан и другие предельные углеводороды), угля, торфа, древесины, нефти и горного воска.
Выделяют лабораторные и промышленные способы получения алканов. В промышленности алканы получают из битумного угля (1) или по реакции Фишера-Тропша (2):
nC + (n+1)h3 = Cnh3n+2 (1)
nCO + (2n+1)h3 = Cnh3n+2 + h3O (2)
К лабораторным способам получения алканов относят: гидрирование непредельных углеводородов при нагревании и в присутствии катализаторов (Ni, Pt, Pd) (1), взаимодействием воды с металлоорганическими соединениями (2), электролизом карбоновых кислот (3), по реакциям декарбоксилирования (4) и Вюрца (5) и другими способами.
R1-C≡C-R2 (алкин) → R1-CH = CH-R2 (алкен) → R1-Ch3 – Ch3 -R2 (алкан) (1)
R-Cl + Mg → R-Mg-Cl + h3O → R-H (алкан) + Mg(OH)Cl (2)
Ch4COONa↔ Ch4COO— + Na+
2Ch4COO— → 2CO2↑ + C2H6 (этан) (3)
Ch4COONa + NaOH → Ch5 + Na2CO3 (4)
R1-Cl +2Na +Cl-R2 →2NaCl + R1-R2 (5)
Примеры решения задач
ru.solverbook.com
Получение. Свойства. - Алканы - Предельные углеводороды - Органическая химия
Физические свойства. В обычных условиях первые четыре члена гомологического ряда алканов (С1 — С4) — газы. Нормальные алканы от пентана до гептадекана (C5 — C17) — жидкости, начиная с С18 и выше — твердые вещества. По мере увеличения числа атомов углерода в цепи, т.е. с ростом относительной молекулярной массы, возрастают температуры кипения и плавления алканов. При одинаковом числе атомов углерода в молекуле алканы с разветвленным строением имеют более низкие температуры кипения, чем нормальные алканы.
Алканы практически нерастворимы в воде, так как их молекулы малополярны и не взаимодействуют с молекулами воды, они хорошо растворяются в неполярных органических растворителях, таких как бензол, тетрахлорметан и др. Жидкие алканы легко смешиваются друг с другом.
Основные природные источники алканов — нефть и природный газ. Различные фракции нефти содержат алканы от C5h22 до С30Н62. Природный газ состоит из метана (95%) с примесью этана и пропана.
Из синтетических методов получения алканов можно выделить следующие:/>
1. Получение из ненасыщенных углеводородов. Взаимодействие алкенов или алкинов с водородом ("гидрирование") происходит в присутствии металлических катализаторов (/>Ni, Pd) принагревании:
| tº. Ni | ||
| СН3-СН=СН2 + Н2 | → | СН3-СН2-СН3, |
СНз—C≡СН + 2Н2 → СН3-СН2-СН3.
2. Получение из галогенпротводных. При нагревании моногалогензамещенных алканов с металлическим натрием получают алканы с удвоенным числом атомов углерода (реакция Вюрца):/>
С2Н5Br + 2Na + Br—C2H5 → C2H5—C2H5 + 2NaBr.
Подобную реакцию не проводят с двумя разными галогензамещенными алканами, поскольку при этом получается смесь трех различных алканов
3. Получение из солей карбоновых кислот. При сплавлении безводных солей карбоновых кислот с щелочами получаются алканы, содержащие на один атом углерода меньше по сравнению с углеродной цепью исходных карбоновых кислот:/>
| t° | ||
| Ch4COONa + NaOH | → | СН4↑ + Na2CO3. |
4.Получение метана. В электрической дуге, горящей в атмосфере водорода, образуется значительное количество метана:/>
С + 2Н2 → СН4.
Такая же реакция идет при нагревании углерода в атмосфере водорода до 400-500 °С при повышенном давлении в присутствии катализатора.
В лабораторных условиях метан часто получают из карбида алюминия:
Аl4С3 + 12Н2О = ЗСН4↑ + 4Аl(ОН)3.
Химические свойства. В обычных условиях алканы химически инертны. Они устойчивы к действию многих реагентов: не взаимодействуют с концентрированными серной и азотной кислотами, с концентрированными и расплавленными щелочами, не окисляются сильными окислителями — перманганатом калия KMnО4 и т.п.
Химическая устойчивость алканов объясняется высокой прочностью s—связей С-С и С-Н, а также их неполярностью. Неполярные связи С-С и С-Н в алканах не склонны к ионному разрыву, но способны расщепляться гомолитически под действием активных свободных радикалов. Поэтому для алканов характерны радикальные реакции, в результате которых получаются соединения, где атомы водорода замещены на другие атомы или группы атомов. Следовательно, алканы вступают в реакции, протекающие по механизму радикального замещения, обозначаемого символом SR (от англ, substitution radicalic). По этому механизму легче всего замещаются атомы водорода у третичных, затем у вторичных и первичных атомов углерода.
1. Галогенирование. При взаимодействии алканов с галогенами (хлором и бромом) под действием УФ-излучения или высокой температуры образуется смесь продуктов от моно- до полигалогензамещенных алканов. Общая схема этой реакции показана на примере метана:/>
| Сl2 | Сl2 | Сl2 | Сl2 | |||||||
| СН4 | → | СН3Сl | → | СН2Сl2 | → | СНСl3 | → | ССl4 | (*) | |
| -HCl | -HCl | -НСl | -HCl |
Реакция образования хлорметана протекает по цепному механизму, который характеризуется следующими стадиями:
а) инициирование цепи:
б) Рост цепи. Радикал хлора отнимает у молекулы алкана атом водорода:
Cl·+ СН4→НС/>l + СН3·
При этом образуется алкильный радикал, который отнимает атом хлора у молекулы хлора:
СН3· + Сl2→СН3Сl + Сl·
Эти реакции повторяются до тех пор, пока не произойдет обрыв цепи по одной из реакций:
Cl· + Cl· → Сl/>2, СН3· + СН3· → С2Н6, СН3· + Cl· → СН3Сl·
Суммарное уравнение реакции:
| hv | ||
| СН4 + Сl2 | → | СН3Сl + НСl. |
Образующийся хлорметан может подвергаться дальнейшему хлорированию, давая смесь продуктов Ch3Cl2, CHCl3, ССl4 по схеме (*).
Развитие теории цепных свободнорадикальных реакций тесно связано с именем выдающегося русского ученого, лауреата Нобелевской премии Н.И. Семенова (1896-1986).
2. Нитрование (реакция Коновалова). При действии разбавленной азотной кислоты на алканы при 140°С и небольшом давлении протекает радикальная реакция:/>
| t ° | ||
| Ch4-Ch4 + HNO3 | → | Ch4-Ch3-NO2 + h3O./>/> |
При радикальных реакциях (галогенирование, нитрование) в первую очередь замешаются атомы водорода у третичных, затем у вторичных и первичных атомов углерода. Это объясняется тем, что легче всего разрывается гомолитически связь третичного атома углерода с водородом (энергия связи 376 кДж/моль), затем — вторичного (390 кДж/моль) и только потом — первичного (415 кДж/моль).
3. Изомеризация. Нормальные алканы при определенных условиях могут превращаться в алканы с разветвленной цепью:/>
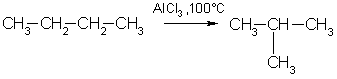
4. Крекинг — это гемолитический разрыв связей С-С, который протекает при нагревании и под действием катализаторов.При крекинге высших алканов образуются алкены и низшие алканы, при крекинге метана и этана образуются ацетилен:/>
C/>8h28 → C4h20 + С4Н8,/>
2СН4 → С2Н2 + ЗН2,
С2Н6 → С2Н2+ 2Н2.
Эти реакции имеют большое промышленное значение. Таким путем высококипящие фракции нефти (мазут) превращают в бензин, керосин и другие ценные продукты.
5. Окисление. При мягком окислении метана кислородом воздуха в присутствии различных катализаторов могут быть получены метиловый спирт, формальдегид, муравьиная кислота:
 |
Мягкое каталитическое окисление бутана кислородом воздуха — один из промышленных способов получения уксусной кислоты:
t° 2C4/>H/>10 + 5O/>2 → 4CH/>3COOH/> + 2Н2О . кат
На воздухе алканы сгорают до СО2 и Н2О:/>
СnН2n+2 + (Зn+1)/2О2 = nСО2 + (n+1)Н2О.
www.himhelp.ru
Алканы — номенклатура, получение, химические свойства » HimEge.ru
Алканы — углеводороды, в молекулах которых атомы связаны одинарными связями и которые соответствуют общей формуле Cnh3n+2.В молекулах алканов все атомы углерода находятся в состоянии sр3-гибридизации. Это означает, что все четыре гибридные орбитали атома углерода одинаковы по форме, энергии и направлены в углы равносторонней треугольной пирамиды — тетраэдра. Углы между орбиталями равны 109° 28′.

Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение, и молекулы алканов могут приобретать самую разнообразную форму с углами при атомах углерода, близкими к тетраэдрическому (109° 28′), например, в молекуле н-пентана.

Особо стоит напомнить о связях в молекулах алканов. Все связи в молекулах предельных углеводородов одинарные. Перекрывание происходит по оси,соединяющей ядра атомов, т. е. это σ-связи. Связи углерод — углерод являются неполярными и плохо поляризуемыми. Длина С—С связи в алканах равна 0,154 нм (1,54 • 10—10 м). Связи С—Н несколько короче. Электронная плотность немного смещена в сторону более электроотрицательного атома углерода, т. е. связь С—Н является слабополярной.
Отсутствие в молекулах предельных углеводородов полярных связей приводит к тому, что они плохо растворяются в воде, не вступают во взаимодействие с заряженными частицами (ионами). Наиболее характерными для алканов являются реакции, протекающие с участием свободных радикалов.
Гомологический ряд метана
Гомологи — вещества, сходные по строению и свойствам и отличающиеся на одну или более групп СН2.

Изомерия и номенклатура
Для алканов характерна так называемая структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Простейший алкан, для которого характерны структурные изомеры, — это бутан.
Основы номенклатуры
1. Выбор главной цепи. Формирование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле, которая является как бы ее основой.2. Нумерация атомов главной цепи. Атомам главной цепи присваивают номера. Нумерация атомов главной цепи начинается с того конца, к которому ближе стоит заместитель (структуры А, Б). Если заместители находятся на равном удалении от конца цепи, то нумерация начинается от того конца, при котором их больше (структура В). Если различные заместители находятся на равном удалении от концов цепи, то нумерация начинается с того конца, к которому ближе старший (структура Г). Старшинство углеводородных заместителей определяется по тому, в каком порядке следует в алфавите буква, с которой начинается их название: метил (—СН3), затем этил (-СН2-СН3), пропил (-СН2-СН2-СН3) и т. д.Обратите внимание на то, что название заместителя формируется заменой суффикса -ан на суффикс —ил в названии соответствующего алкана.3. Формирование названия. В начале названия указывают цифры — номера атомов углерода, при которых находятся заместители. Если при данном атоме находятся несколько заместителей, то соответствующий номер в названии повторяется дважды через запятую (2,2-). После номера через дефис указывают количество заместителей (ди — два, три — три, тетра — четыре, пента — пять) и название заместителя (метил, этил, пропил). Затем без пробелов и дефисов — название главной цепи. Главная цепь называется как углеводород — член гомологического ряда метана ( метан СН4, этан С2Н6, пропан C3H8, бутан С4Н10, пентан С5Н12, гексан С6Н14, гептан C7h26, октан C8h28,нонан С9Н20, декан С10Н22).

Физические свойства алканов
Первые четыре представителя гомологического ряда метана — газы. Простейший из них — метан — газ без цвета, вкуса и запаха (запах «газа», почувствовав который, надо звонить 04, определяется запахом меркаптанов — серосодержащих соединений, специально добавляемых к метану, используемому в бытовых и промышленных газовых приборах для того, чтобы люди, находящиеся рядом с ними, могли по запаху определить утечку).Углеводороды состава от С4Н12 до С15Н32 — жидкости; более тяжелые углеводороды — твердые вещества. Температуры кипения и плавления алканов постепенно увеличиваются с возрастанием длины углеродной цепи. Все углеводороды плохо растворяются в воде, жидкие углеводороды являются распространенными органическими растворителями.
Химические свойства алканов
Реакции замещения.Наиболее характерными для алканов являются реакции свободнорадикального замещения, в ходе которого атом водорода замещается на атом галогена или какую-либо группу. Приведем уравнения характерных реакций галогенирования:
 В случае избытка галогена хлорирование может пойти дальше, вплоть до полного замещения всех атомов водорода на хлор:
В случае избытка галогена хлорирование может пойти дальше, вплоть до полного замещения всех атомов водорода на хлор: Полученные вещества широко используются как растворители и исходные вещества в органических синтезах.Реакция дегидрирования (отщепления водорода).В ходе пропускания алканов над катализатором (Pt, Ni, А1203, Сг203) при высокой температуре (400-600 °С) происходит отщепление молекулы водорода и образование алкена:
Полученные вещества широко используются как растворители и исходные вещества в органических синтезах.Реакция дегидрирования (отщепления водорода).В ходе пропускания алканов над катализатором (Pt, Ni, А1203, Сг203) при высокой температуре (400-600 °С) происходит отщепление молекулы водорода и образование алкена: Реакции, сопровождающиеся разрушением углеродной цепи.Все предельные углеводороды горят с образованием углекислого газа и воды. Газообразные углеводороды, смешанные с воздухом в определенных соотношениях, могут взрываться.1. Горение предельных углеводородов — это свободнорадикальная экзотермическая реакция, которая имеет очень большое значение при использовании алканов в качестве топлива:
Реакции, сопровождающиеся разрушением углеродной цепи.Все предельные углеводороды горят с образованием углекислого газа и воды. Газообразные углеводороды, смешанные с воздухом в определенных соотношениях, могут взрываться.1. Горение предельных углеводородов — это свободнорадикальная экзотермическая реакция, которая имеет очень большое значение при использовании алканов в качестве топлива: В общем виде реакцию горения алканов можно записать следующим образом:
В общем виде реакцию горения алканов можно записать следующим образом: 2. Термическое расщепление углеводородов.
2. Термическое расщепление углеводородов.
Процесс протекает по свободнорадикальному механизму. Повышение температуры приводит к гомолитическому разрыву углерод-углеродной связи и образованию свободных радикалов.

Эти радикалы взаимодействуют между собой, обмениваясь атомом водорода, с образованием молекулы алкана и молекулы алкена:

Реакции термического расщепления лежат в основе промышленного процесса — крекинга углеводородов. Этот процесс является важнейшей стадией переработки нефти.
3. Пиролиз. При нагревании метана до температуры 1000 °С начинается пиролиз метана — разложение на простые вещества: При нагревании до температуры 1500 °С возможно образование ацетилена:
При нагревании до температуры 1500 °С возможно образование ацетилена: 4. Изомеризация. При нагревании линейных углеводородов с катализатором изомеризации (хлоридом алюминия) происходит образование веществ с разветвленным углеродным скелетом:
4. Изомеризация. При нагревании линейных углеводородов с катализатором изомеризации (хлоридом алюминия) происходит образование веществ с разветвленным углеродным скелетом: 5. Ароматизация. Алканы с шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола и его производных:
5. Ароматизация. Алканы с шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола и его производных:
Алканы вступают в реакции, протекающие по свободнорадикальному механизму, т. к. все атомы углерода в молекулах алканов находятся в состоянии sp3-гибридизации. Молекулы этих веществ построены при помощи ковалентных неполярных С—С (углерод — углерод) связей и слабополярных С—Н (углерод — водород) связей. В них нет участков с повышенной и с пониженной электронной плотностью, легко поляризуемых связей, т. е. таких связей, электронная плотность в которых может смещаться под действием внешних факторов (электростатических полей ионов). Следовательно, алканы не будут реагировать с заряженными частицами, т. к. связи в молекулах алканов не разрываются по гетеролитическому механизму.

Способы получения


himege.ru
Предельные углеводороды. Алканы.
Алканы являются насыщенными углеводородами и содержат максимально возможное число атомов водорода. Простейшим представителем класса является метан ( Ch5).
По номенклатуре ИЮПАК названия алкано в образуются при помощи суффикса -ан путём добавления к соответствующему корню от названия углеводорода. Выбирается наиболее длинная неразветвлённая углеводородная цепь так, чтобы у наибольшего числа заместителей был минимальный номер в цепи. В названии соединения цифрой указывают номер углеродного атома, при котором находится замещающая группа или гетероатом, затем название группы или гетероатома и название главной цепи.
Для алканов характерен тип гибридизации - sp3.
Пространственное строение - у метана тетраэдрическая форма молекулы, у алканов n>4 - зигзагообразная форма.
Изомерия предельных углеводородов обусловлена простейшим видом структурной изомерии — изомерией углеродного скелета. Гомологическая разница - -Ch3-.
Физические свойства
Температуры плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи. При нормальных условиях неразветвлённые алканы с Ch5 до C4h20 — газы; с C5h22 до C13h38 — жидкости; после C14h40 — твёрдые тела. Температуры плавления и кипения понижаются от менее разветвленных к более разветвленным. Газообразные алканы горят бесцветным или бледно-голубым пламенем с выделением большого количества тепла.
Химические свойства алканов
Галогенирование — это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атомы галогенируются в последнюю очередь). Галогенирование алканов проходит поэтапно — за один этап замещается не более одного атома водорода:
Ch5 + Cl2 → Ch4Cl + HCl (хлорметан)Ch4Cl + Cl2 → Ch3Cl2 + HCl (дихлорметан)Ch3Cl2 + Cl2 → CHCl3 + HCl (трихлорметан)CHCl3 + Cl2 → CCl4 + HCl (тетрахлорметан).
На алканы действует pазбавленная азотная кислота пpи нагpевании и давлении. В pезультате пpоисходит замещение атома водоpода на остаток азотной кислоты – нитpогpуппу NO2.
R-H + HO-NO2 → R-NO2 + h3O
Эту pеакцию называют pеакцией нитpования, а пpодукты pеакции – нитpосоединениями.
Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива, является реакция горения. Пример:
Ch5 + 2O2 → CO2 + 2h3O + Q
Значение Q достигает 46 000 — 50 000 кДж/кг.
В случае нехватки кислорода вместо углекислого газа получается угарный газ или уголь (в зависимости от концентрации кислорода).В общем виде реакцию горения алканов можно записать следующим образом:
СnН2n+2+ (1,5n+0,5)O2 → nCO2 + (n+1)h3O
Реакции разложения происходят лишь под влиянием больших температур. Повышение температуры приводит к разрыву углеродной связи и образованию свободных радикалов.
Примеры:
Ch5 → C + 2h3 (t > 1000 °C)
C2H6 → 2C + 3h3
Крекинг – процесс термического разложения углеводородов, в основе которого лежат реакции расщепления углеродной цепи крупных молекул с образованием соединений с более короткой цепью.
Термический крекинг. При температуре 450–700oС алканы распадаются за счет разрыва связей С–С (более прочные связи С-Н при такой температуре сохраняются) и образуются алканы и алкены с меньшим числом углеродных атомов.
Например:
C6h24 → C2H6 + C4H8
Каталитический крекинг проводят в присутствии катализаторов (обычно оксидов алюминия и кремния) при температуре450°С и атмосферном давлении. При этом наряду с разрывом молекул происходят реакции изомеризации и дегидрирования:
2Ch5 1500°C→ H–C≡C–H (ацетилен) + 3h3
Под влиянием катализаторов при нагревании углеводороды нормального строения подвергаются изомеризации - перестройке углеродного скелета с образованием алканов разветвленного строения.
Ch4–Ch3–Ch3–Ch3–Ch4 (пентан) –t°,AlCl 3 → Ch4–Ch3–Ch3–Ch4I
Ch4 (2-метилбутан)
При нагревании алканов в присутствии катализаторов происходит их каталитическое дегидрирование за счет разрыва связей С-Н и отщепления атомов водорода от соседних углеродных атомов. При этом алкан превращается в алкен с тем же числом углеродных атомов в молекуле:
Cnh3n+2 → Cnh3n + h3
Ch4—Ch4 → Ch3=Ch3 + h3 (этан → этен)
Ch4—Ch3—Ch3—Ch4 → Ch3= CH—Ch3—Ch4+ h3 (бутан → бутен-1)
Наряду с бутеном-1 в этой реакции образуется также бутен-2.
Алканы - соединения с низкими степенями окисления углерода, и в зависимости от условий реакции они могут окисляться с образованием различных соединений.
Получение алканов
Алканы выделяют из природных источников (природный и попутный газы, нефть, каменныйуголь). Используются также синтетические методы.
1. Крекинг нефти (промышленный способ)
При крекинге алканы получаются вместе с непредельными соединениями (алкенами). Этот способ важен тем, что при разрыве молекул высших алканов получается очень ценное сырье для органического синтеза: пропан, бутан, изобутан, изопентан идр.
2. Гидpиpование непpедельных углеводоpодов:
Cnh3n+ h3→Cnh3n+2 ←-h3 Cnh3n-2
алкены → алканы← алкины
3. Газификация твердого топлива (при повышенной температуре и давлении, катализатор Ni):
С + 2Н2 → СН4
4. Из синтез-газа (СО + Н2) получают смесь алканов:
nСО + (2n+1)Н2→ Cnh3n+2+ nh3O
5. Синтез более сложных алканов из галогенопpоизводных с меньшим числом атомов углеpода:
2Ch4Cl + 2Na → Ch4-Ch4 + 2NaCl (реакция Вюрца)
6. Из солей карбоновых кислот:
а) сплавление со щелочью (реакция Дюма
Ch4COONa + NaOH → Ch5 + Na2CO3
ацетат натрия
б) электролиз по Кольбе
2RCOONa + 2h3O → R-R + 2CO2+ h3+ 2NaOH
на аноде → на катоде
7. Разложение карбидов металлов (метанидов) водой:
Al4C3 + 12HOH → 4Al(OH)3 + 3Ch5
Применение алканов.
Предельные углеводороды находят широкое применение в самых разнообразных сферах жизни и деятельности человека.
- Газообразные алканы (метан и пpопан-бутановая смесь) используются в качестве ценного топлива.
- Жидкие углеводоpоды составляют значительную долю в моторных и ракетных топливах и используются в качестве растворителей.
- Вазелиновое масло (смесь жидких углеводоpодов с числом атомов углерода до 15) - пpозpачная жидкость без запаха и вкуса, используется в медицине, паpфюмеpии и косметике.
- Вазелин (смесь жидких и твеpдых пpедельных углеводоpодов с числом углеpодных атомов до 25) пpименяется для пpиготовления мазей, используемых в медицине.
- Паpафин (смесь твеpдых алканов С19 - С35) - белая твеpдая масса без запаха и вкуса (tпл = 50-70°C) - пpименяется для изготовления свечей, пpопитки спичек и упаковочной бумаги, для тепловых пpоцедуp в медицине и т.д.
- Нормальные предельные углеводороды средней молекулярной массы используются как питательный субстрат в микробиологическом синтезе белка из нефти.
- Большое значение имеют галогенопроизводные алканов , которые используются как растворители, хладоагенты и сырье для дальнейших синтезов.
- В современной нефтехимической промышленности предельные улеводороды являются базой для получения разнообразных органических соединений, важным сырьем в процессах получения полупродуктов для производства пластмасс, каучуков, синтетических волокон, моющих средств и многих других веществ.
examchemistry.com
класс алканы | Дистанционные уроки
22-Ноя-2012 | комментарий 21 | Лолита Окольнова
Органическая химия — это химия углерода, валентность которого равна 4. Т.е., каждый атом углерода образует 4 связи (сигма-связи). Это может быть связь — С — С — , это может быть связь -С-H. Одинарная связь считается насыщенной, т.е. достигается максимальное перекрывание электронной плотности между атомами.
Предельные углеводороды —
(углеводороды с насыщенными связями)
Сигма-связь (σ- )

- Атомы углерода находятся в состоянии Sp³-гибридизации:

Т.е. вещества класса Алканы (парафины — старое название) – алифатические (нециклические) предельные углеводороды, в которых атомы углерода связаны между собой простыми (одинарными, насыщенными) связями в неразветвленные или разветвленные цепи. Угол между связями С-C составляет 109°28′, поэтому молекулы нормальных алканов с большим числом атомов углерода имеют зигзагообразное строение (зигзаг)

Общая формула алканов:
Сnh3n+2
n = числу атомов углерода.
Номенклатура веществ класса алканов строится из двух частей.
Первая часть «говорит» о количестве атомов углерода, вторая — о связи -С-С-. У алканов вторая часть — всегда -ан, а первую часть надо выучить:
| Название (приставка) | Количество атомов углерода | Формула |
| мет-(метан) | 1 | Ch5 |
| эт-(этан) | 2 | C2H6 |
| проп-(пропан) | 3 | C3H8 |
| бут-(бутан) | 4 | C4h20 |
| пент-(пентан) | 5 | C5h22 |
| гекс-(гексан) | 6 | C6h24 |
Физические свойства алканов:
C1-C4 — газообразные вещества;
С5- С17 — жидкости;
С18-… — твердые вещества.
класс алканы —
Химические свойства
Алканы — довольно химически устойчивы. Между атомами насыщенная связь, поэтому вещества класса алканы очень слабо активны.
Максимум на что они способны это:
Реакции замещения: реакция идет на свету по радикальному механизму:
- С2H6 + Cl2 = C2H5Cl + HCl, такое замещение может идти до полного замещения атомами хлора атомов водорода: С2Сl6.Реакция Вюрца — «именная» реакция удлиннения цепи: C2H5Cl + 2Na +ClC2H5 → C4h20 + 2NaCl (из этана получили бутан)
- Реакция Коновалова: c разбавленной азотной кислотой под давлениемС2H6 + HNO3 (HO-NO2) → С2H5NO2 + h3O
Реакции разложения (крекинг): длинные вещества класса алканы разлагается на алкан (более короткий) и алкен:Ch4–Ch3–Ch4(пропан) –400°C> Ch5(метан)+ Ch3=Ch3 (этилен)
Окисление алканов (горение): как и все органические вещества, алканы горят до образования углекислого газа и воды:
2C2H6 + 7O2 = 4CO2 + 6h3O
Получение веществ класса алканы:
- Из неорганических веществ: гидролиз карбида алюминия:Al4C3 + 12h3O = 4Al(OH)3 +3Ch5 (метан)C+2h3 = Ch5 (при высоком давлении и температуре)
- Гидрирование алкенов:С2h5 + h3 = C2H6 (этан)
- Еще одна «именная» реакция: реакция Кольбе: электролиз солей карбоновых кислот:2Сh4COONa -(электролиз)-→ Сh4-Ch4 (этан) + 2СO2 +2Na
- Реакция солей карбоновых кислот с аналогичными щелочами:C2H5COONa + NaOH ––t°> C2H6 + Na2CO3
Вопрос из олимпиадных заданий (2015 г)

Давайте сначала определимся с атомами углерода — какие из них будут третичными
Вот пример:

«Третичный» — атом углерода, связанный с тремя другими атомами С
- н-гептан — гептан линейного строение, «без ответвлений» — только первичные и вторичные атомы СCh4-Ch3-Ch3-Ch3-Ch3-Ch4
название по номенклатуре ИЮПАК — 2,2-диметилбутан
В этом веществе будут 3 первичных атома (Ch4-), один вторичный (-Ch3-) и один четвертичный (С)
- в ЕГЭ это вопрос А13 и А14 — Строение и свойства углеводородов
- в ГИА (ОГЭ) это B2 — Первоначальные сведения об органических веществах: предельных и непредельных углеводородах
Категории: |
Обсуждение: "Класс алканы"
(Правила комментирования)distant-lessons.ru
Углеводороды. Алканы. Строение, получение и свойства
 Сегодня урок по химии 29 — Углеводороды. Алканы. Строение, получение и свойства.
Сегодня урок по химии 29 — Углеводороды. Алканы. Строение, получение и свойства.
Углеводороды — органические соединения, в состав которых входят только два элемента: углерод и водород.
Алканы – алифатические (ациклические) предельные углеводороды, в которых атомы углерода связаны между собой простыми (одинарными) связями, состав которых выражается общей формулой Cnh3n+2, где n – число атомов углерода.
Алканы являются углеводородами, наиболее богатыми водородом, они насыщены им до предела. Отсюда название – насыщенные или предельные углеводороды. Их также называют парафинами. Общая черта в строении алканов и циклоалканов – простая или одинарная связь между атомами углерода. На образование этой связи затрачивается одна пара электронов, причем максимальное перекрывание орбиталей находится на линии, соединяющей центры атомов. Такую связь называют σ-связью, а электроны, образующие её – σ-электронами. Распределение электронной плотности σ‑ связи симметрично относительно оси, проходящей через центры связанных атомов
Все атомы углерода находятся в состоянии sp3— гибридизации, валентный угол равен 109о28’, длина связи С – С составляет 1,54 Ао. Ниже приводятся формулы и названия первых десяти членов гомологического ряда предельных углеводородов и соответсвующих им алкильных радикалов.
Гомологический ряд алканов
| Мелекулярная формула иНазвание алкана | Формула и название алкильного радикала |
| СН4 , метан | — СН3, метил |
| С2Н6, этан | — С2Н5, этил |
| С3 Н8, пропан | — С3 Н7, пропил |
| С4 Н10, бутан | — С4 Н9, бутил |
| С5 Н12, пентан | — С 5Н11, пентил (амил) |
| С6 Н14, гексан | — С6 Н13, гексил |
| С7 Н16, гептан | — С 7Н15, гептил |
| С8 Н18, октан | — С8 Н17, октил |
| С9 Н20, нонан | — С9 Н19, нонил |
| С10 Н22, декан | — С10 Н21, децил |
- Для простейших алканов (С1-С4) приняты тpивиальные названия: метан, этан, пpопан, бутан, изобутан.
- Начиная с пятого гомолога, названия нормальных (неpазветвленных) алканов стpоят в соответствии с числом атомов углеpода, используя гpеческие числительные и суффикс -ан: пентан, гексан, гептан, октан, нонан, декан и т.д.
- В основе названия разветвленного алкана лежит название входящего в его конструкцию нормального алкана с наиболее длинной углеродной цепью. При этом углеводоpод с pазветвленной цепью pасcматpивают как пpодукт замещения атомов водоpода в ноpмальном алкане углеводоpодными pадикалами.
Напишем формулы изомеров гексана:
СН3-СН2-СН2-СН2-СН2-СН3 — н-гексан
СН3-СН(СН3) -СН2-СН2-СН3 СН3-СН2-СН(СН3)-СН2-СН3
2-метилпентан 3-метилпентан
СН3 –С( СН3)2– СН2— СН3 СН3-СН(Ch4)-СН(Ch4)- СН3
2,2-диметилбутан 2,3 –диметилбутан
Спосoбы получения алканов.
1. По реакции Вюрца – действием металлического натрия на галоидные алкилы:
СН3 – СI + 2Nа + СI – СН3 → СН3 – СН3 + 2NаСI
2. Сплавлением натриевых солей карбоновых кислот с едкими щелочами:
СН3 –СН2 – СООNа + NаОН → СН 3–СН3 + Nа2СО3.
3. Гидролиз карбида алюминия, получается метан:
АI4С3 + 12Н2О → 3СН4 + 4АI(ОН)3.
4. Гидрирование непредельных углеводородов в присутствии катализаторов.
СnН2n + Н2 → СnН2n+2
5. Синтез из оксида углерода (II) и водорода:
nСО + (2n+1)Н2 → Cnh3n+2 + nН2О
Химические свойства алканов.
1. Галогенирование (реакция радикального замещения):
СН4 + СI2 → СН3СI + HCl
2. Нитрование (реакция М.И.Коновалова) на примере 3-метилпентана:
СН3 — СН2 – СН(СН3) – СН2СН3 + НО — NО2 → СН3–СН2 -С(СН3)(NО2)–СН2-СН3 +Н2О
3-метил-пентан 3-метил-3-нитропентан
3. Сульфирование:
СН3 – СН2 – СН2 – СН3 +НО -SО3Н → СН 3– СН(SО3Н) – СН2 – СН3 + Н2 О
Бутан 2-сульфобутан (бутан-2-сульфокислота).
4. Реакции окисления.
а) неполное окисление 2СН4 + 3О2 → 2СО + 4Н2О
б) полное окисление СН4 + 2О2 → СО 2 + 2Н2О
5. Крекинг ( расщепление ) алканов.
С4Н10 → С2Н6 + СН2 = СН2
6. Дегидрирование:
СН3 – СН3 → СН2 = СН2 + Н2↑
Этан Этен
Метан используется в основном в качестве дешевого топлива. При горении он дает почти бесцветное пламя. Из метана получают ценные химические продукты: метанол, синтез-газ, формальдегид, ацетилен, различные хлорпроизводные. Этан используется при синтезе этилена. Пропан в смеси с бутаном используется в качестве топлива. Средние члены гомологического ряда используют как горючее для двигателей (бензин, керосин), а также в качестве растворителей. Высшие алканы – топливо для дизельных двигателей, смазочные масла и сырье для производства моющих средств.
Это был урок по химии 29 — Углеводороды. Алканы. Строение, получение и свойства.
Расскажите об этой статье друзьям:
Friend me:
к нашему сайту.
sovety-tut.ru