Физико-химические свойства глинозема . Al2O3 вода
Химические свойства амфотерных оксидов | CHEMEGE.RU
Перед изучением этого раздела рекомендую изучить следующие темы:
Классификация неорганических веществ
Классификация оксидов, способы их получения
Химические свойства основных оксидов
Химические свойства кислотных оксидов
Амфотерные оксиды проявляют свойства и основных, и кислотных. От основных отличаются только тем, что могут взаимодействовать с растворами и расплавами щелочей и с расплавами основных оксидов, которым соответствуют щелочи.
1. Амфотерные оксиды взаимодействуют с кислотами и кислотными оксидами.
При этом по правилу «хотя бы один из реагентов должен быть сильным» амфотерные оксиды взаимодействуют, как правило, с сильными и средними кислотами и их оксидами.
Например, оксид алюминия взаимодействует с соляной кислотой, оксидом серы (VI), но не взаимодействует с углекислым газом и кремниевой кислотой:
амфотерный оксид + кислота = соль + вода
Al2O3 + 6HCl = 2AlCl3 + 3h3O
амфотерный оксид + кислотный оксид = соль
Al2O3 + 3SO3 = Al2(SO4)3
Al2O3 + CO2 ≠
Al2O3 + h3SiO3 ≠
2. Амфотерные оксиды не взаимодействуют с водой.
Оксиды взаимодействуют с водой, только когда им соответствуют растворимые гидроксиды, а все амфотерные гидроксиды — нерастворимые.
3. Амфотерные оксиды взаимодействуют с щелочами.
При этом механизм реакции и продукты различаются в зависимости от условий проведения процесса — в растворе или расплаве.
В растворе образуются комплексные соли, в расплаве — обычные соли.
Формулы комплексных гидроксосолей составляем по схеме:
- Сначала записываем центральный атом-комплекообразователь (это, как правило, амфотерный металл).
- Затем дописываем к центральному атому лиганды — гидроксогруппы. Число лигандов в 2 раза больше степени окисления центрального атома (исключение — комплекс алюминия, у него, как правило, 4 лиганда-гидроксогруппы).
- Заключаем центральный атом и его лиганды в квадратные скобки, рассчитываем суммарный заряд комплексного иона.
- Дописываем необходимое количество внешних ионов. В случае гидроксокомплексов это — ионы основного металла.
Основные продукты взаимодействия соединений амфотерных металлов со щелочами сведем в таблицу.
| Металлы | В расплаве щелочи | В растворе щелочи |
| Степень окисле-ния +2 (Zn, Sn, Be) | Соль состава X2YO2*. Например: Na2ZnO2 | Комплексная соль состава Х2[Y(OH)4]*. Например: Na2[Zn(OH)4] |
| Степень окисле-ния +3 (Al, Cr, Fe) | Соль состава XYO2 (мета-форма) или X3YO3 (орто-форма). Например: NaAlO2 или Na3AlO3 | Комплексная соль состава Х3[Y(OH)6]* или реже Х[Y(OH)4]. Например: Na3[Al(OH)6] или Na[Al(OH)4] |
* здесь Х — щелочной металл, Y — амфотерный металл.
Исключение — железо не образует гидроксокомплексы в растворе щелочи!
Например:
амфотерный оксид + щелочь (расплав) = соль + вода
Al2O3 + 2NaOH = 2NaAlO2 + h3O
амфотерный оксид + щелочь (раствор) = комплексная соль
ZnO + 2NaOH + h3O = Na2[Zn(OH)4]
4. Амфотерные оксиды взаимодействуют с основными оксидами.
При этом взаимодействие возможно только с основными оксидами, которым соответствуют щелочи и только в расплаве. В растворе основные оксиды взаимодействуют с водой с образованием щелочей.
амфотерный оксид + основный оксид = соль + вода
Al2O3 + Na2O = 2NaAlO2
5. Окислительные и восстановительнеы свойства.
Амфотерные оксиды способны выступать и как окислители, и как восстановители по тем же закономерностям и принципам, что и основные оксиды. Окислительно-восстановительные свойства подробно рассмотрены в статье про основные оксиды.
Поделиться ссылкой:
chemege.ru
Физико-химические свойства глинозема
Прежде чем перейти к характеристике отдельных процессов получения (извлечения) чистой окиси алюминия из руд, необходимо кратко ознакомиться с некоторыми физико-химическими свойствами глинозема, определяющими поведение его в этих процессах.
Полиморфизм глинозема. Полиморфизм, мак известно, представляет собой способность одного и того же вещества образовывать различные типы кристаллической (пространственной) решетки — давать полиморфные разности, обладающие нередко глубоким различием в свойствах.
Для безводной окиси алюминия обнаружено несколько полиморфных разностей, из которых, однако, безусловно установлены, хорошо изучены и имеют большое значение в производстве глинозема две, которые мы и рассмотрим ниже,
Первая из них – a—Al2O3 или корунд, известна с давних времен и является единственной формой безводной окиси алюминия, встречающейся в естественных горных породах в виде бесцветных или окрашенных небольшими примесями других окислов кристаллов (рубин, сапфир). Чистый расплавленный глинозем во время остывания кристаллизуется в форме a—Al2O3. Все виды гидратов окиси алюминия при нагревании до 1200° также превращаются а a—Al2O3. Кристаллизуется корунд в гексагональной системе, причем внешний вид кристаллов обычно веретенообразный или бочкообразный (фиг. 9). Корунд отличается высокой твердостью, занимая в минералогической шкале Мооса предпоследнее перед алмазом место — 9. Он практически не гигроскопичен и имеет наибольший удельный вес из всех полиморфных разностей Al2O3—3,9—4,0.
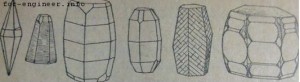
Кристаллические формы корунда
Вторая полиморфная разность безводной окиси алюминия — y—Al2O3, открытая Ульрихом в 1925 г., кристаллизуется в кубической системе (размер ребра куба элементарной кристаллической ячейки — 7,90 * 10-8 см) в характерных октаедрических формах. В природе y—Al2O3 не встречаемся и образуется при обезвоживании трехводной окиси алюминия — гидр аргиллита в температурном интервале 500 — 900°. Отличается большой дисперсностью и гигроскопичностью. Удельный вес y—Al2O3 — 3,77. При нагревании выше 900° y—Al2O3 начинает превращаться в a—Al2O3, что полностью завершается при 1200°.
Водная окись алюминия известна в виде следующих стабильных форм: диаспора, бемита и гидраргиллита.
Диаспор и бемит являются полиморфными разностями одноводной окиси алюминия и отвечают химическому составу метаалюминиевой кислоты (НAlO2):
Al2O3* h3O=2AlOOH=2 НAlO2
Как диаспор, так и бемит встречаются в виде природных минералов, входя в состав бокситов. Бемит образуется также при обезвоживании гидраргиллита при 250°. Оба кристаллизуются в ромбической системе, отличаясь друг от друга показателями преломления. Обычной формой кристаллов диаспора являются плоские призмы. При нагревании до 500° диаспор и бемит полностью теряют кристаллизационную воду, превращаясь в безводную окись. Однако характер процесса обезвоживания для диаспора и бемита не одинаков. Кривая обезвоживания диаспора показывает, что дегидратация этого минерала происходит полностью в температурном интервале 410—450° и является линейной функцией температуры. Кривая же обезвоживания бемита имеет другой вид и состоит из двух характерных участков. Первый из них лежит между 300 и 450° и имеет форму гиперболической кривой. В этом температурном интервале удаляется только примерно 25% кристаллизационной воды бемита. Второй участок находится между 450 и 490° и соответствует более интенсивному обезвоживанию, аналогичному для диаспора. Таким образом, если удаление связанной воды для диаспора заканчивается полностью при 450°, то для бемита этот процесс только начинается, оканчиваясь, примерно, при 500°. Для смесей диаспора и бемита кривые их обезвоживания занимают промежуточное положение. При обезвоживании диаспор превращается непосредственно в a—Al2O3, а бемит —- сначала в y—Al2O3.
Гидраргиллит, или гибсит, является, по-видимому, единственной формой трехводной окиси алюминия. Полиморфной разности для нее не обнаружено, Гидраргиллит отвечает химическому составу ортоалюминиевой кислоты (Н3А1О3): Al2O3*3 h3O=2А1(ОН)3=2 Н3А1О3. Встречается в природе как минерал и входит в состав бокситов. Кристаллизуется в моноклинной системе в виде табличек. Представляет собой конечную форму кристаллической гидроокиси алюминия, выпадающей из алюминиевых растворов при низких температурах. Гидраргиллит, обезвоженный при 250°, теряет две молекулы кристаллизационной воды, превращаясь в бемит.
В соответствии с изложенным различные формы окиси и гидроокиси алюминия индивидуальной кристаллической решеткой могут быть классифицированы в два полиморфные ряда (ряды Габера) — a — ряд и y — ряд.
| a — ряд | y — ряд |
| Отсутствует Al(OH)3 | Гидраргиллит Al(OH)3 |
| Диаспорит AlOOH | Бемит AlOOh2 |
| Корунд a—Al2O3 | y—Al2O3 |
В обоих рядах приведены лишь конечные стабильные формы. Вообще же среди гидратных форм окиси алюминия наблюдаются промежуточные образования, стремящиеся к этим стабильным формам. Так, при определенных условиях из алюминиевых солей в щелочной среде гидроокись алюминия вначале выделяется в форме байерита, который затем переходит в гидраргиллит. Аммиак осаждает гидроокись алюминия в аморфной форме.
Температура плавления и кипения глинозема. Безводный глинозем является термически стойким окислом, отличаясь высокой температурой плавления и кипения. Температура плавления a—Al2O3 равна 2050°. Температура же кипения безводной окиси алюминия при атмосферном давлении составляет 2980°.
Теплота образования глинозема. Безводная окись алюминия — весьма прочное соединение. Теплота образования ее значительно выше теплот образования основных примесей, входящих в состав алюминиевых руд. Это обстоятельство позволяет выделять окись алюминия из руд как таковую (в виде корунда) или же в форме шлаков, восстанавливая углеродом примеси до элементарного (металлического) состояния. Сама же окись алюминия в этих условиях восстанавливается до металла лишь ,в ничтожной степени.
Рот, Вольф и Фриц в 1940 г. Сжиганием электролитически-рафинированного алюминия определили теплоту образования Al2O3 при 22° равной 402 ± 0,3 б. кал/г-мол. Для сравнения укажем, что для SiO2 и ТiO2 эти величины соответственно составляют 208 и 225 б. кал/г-мол.
Химические свойства глинозема. Глинозем является типичным амфотерным химическим соединением, основные и кислотные свойства которого выражены, примерно, в одинаковой степени. Существуя в трехводной и одноводной формах, гидроокись алюминия, как мы указывали выше, может соответственно рассматриваться в первом случае, как трехосновная ортоалюминиевая кислота (Н3AlO3) и во втором случае, как одноосновная метаалюминиевая кислота (НAlO2).
Благодаря своему амфотермому характеру, глинозем может растворяться и в кислотах и в щелочах. Наименьшей растворимостью обладает при этом a—Al2O3; более растворим y—Al2O3, Особенно же легко растворяется (гидроокись алюминия, причем по возрастанию интенсивности растворения в едком натре различные формы ее могут быть расположены в следующий ряд:
Диаспор — бемит — гидраргиллит.
В растворах кислот гидроокись алюминия ведет себя как основание, образуя алюминиевые соли соответствующих кислот, например:
2Al(OH)3+3h3SO4= Al2(SO4)3 +6h3O.
В растворах же оснований гидроокись алюминия проявляет себя как кислота, образуя щелочные соли этой кислоты алюминаты, например:
2Al(OH)3+NaOH=NaAlO2+2h3O.
При высокой температуре с сульфидами тяжелых металлов в присутствии восстановителя окись алюминия дает сульфид алюминия, плавящийся при 1100°:
Al2O3+3FeS+3C=Al2S+3Fe+3CO.
С азотом при высокой температуре окись алюминия образует соответственно нитрид алюминия:
Al2O3+3C+N2=2AlN+3CO.
Наконец, при высоких температурах окись алюминия с соединениями щелочных и щелочно-земельных металлов образует также соответствующие алюминаты, например метаалюминат наnрия — Na2O*Al2O3 (с температурой плавления 1650°) или метаалюминат кальция СаО*Al2O3 (с nемпературой плавления 1600°), которые играют большую роль в промышленных методах производства глинозема.
for-engineer.info
Амфотерные оксиды. Химические свойства, способ получения
Амфотерные оксиды (имеющие двойственные свойства) – это в большинстве случаев оксиды металлов, которые обладают небольшой электроотрицательностью. В зависимости от внешних условий проявляют либо кислотные, либо оксидные свойства. Образуются эти оксиды переходными металлами, которые обычно проявляют следующие степени окисления: ll, lll, lV.
Примеры амфотерных оксидов: цинка оксид (ZnO), хрома оксид lll (Cr2O3), алюминия оксид (Al2O3), олова оксид ll (SnO), олова оксид lV (SnO2), свинца оксид ll (PbO), свинца оксид lV (PbO2), титана оксид lV (TiO2), марганца оксид lV (MnO2), железа оксид lll (Fe2O3), бериллия оксид (BeO).
Реакции, характерные для амфотерных оксидов:
1. Эти оксиды могут реагировать с сильными кислотами. При этом образуются соли этих же кислот. Реакции такого типа являются проявлением свойств основного типа. Например: ZnO (оксид цинка) + h3SO4 (соляная кислота) → ZnSO4 (сульфат цинка) + h3O (вода).
2. При взаимодействии с сильными щелочами амфотерные оксиды и гидроксиды проявляют кислотные свойства. При этом двойственность свойств (то есть амфотерность) проявляется в образовании двух солей.
В расплаве при реакции с щелочью образуется соль средняя обычная, например:ZnO (оксид цинка) + 2NaOH (гидроксид натрия) → Na2ZnO2 (обычная средняя соль) + h3O (вода).Al2О3 (оксид алюминия) + 2NaOH (гидроксид натрия) = 2NaAlO2 + h3O (вода).2Al(OH)3 (алюминия гидроксид) + 3SO3 (оксид серы) = Al2(SO4)3 (алюминия сульфат) + 3h3O (вода).
В растворе амфотерные оксиды при реакции с щелочью образуют комплексную соль, например: Al2O3 (алюминия оксид) + 2NaOH (гидроксид натрия)+ 3h3O (вода) + 2Na(Al(OH)4) (комплексная соль тетрагидроксоалюминат натрия).
3. Каждый металл любого амфотерного оксида имеет свое координационное число. Например: для цинка (Zn) - 4, для алюминия (Al) - 4 или 6, для хрома (Cr) - 4 (редко) или 6.
4. Амфотерный оксид не реагирует с водой и не растворяется в ней.
Какие реакции доказывают амфотерность металла?
Условно говоря, амфотерный элемент может проявлять свойства как металлов, так и неметаллов. Подобная характерная особенность присутствует у элементов А-групп: Be (бериллий), Ga (галлий), Ge (германий), Sn (олово), Pb, Sb (сурьма), Bi (висмут) и некоторые другие, а также многие элементы Б-групп - это Cr (хром), Mn (марганец), Fe (железо), Zn (цинк), Cd (кадмий) и другие.
Докажем следующими химическими реакциями амфотерность химического элемента цинка (Zn):
1. Zn(OH)2 (цинка гидроксид) + N2O5 (пентаоксид диазота) = Zn(NO3)2 (нитрат цинка) + h3O (вода).ZnO (оксид цинка) + 2HNO3 (азотная кислота) = Zn(NO3)2 (нитрат цинка) + h3O (вода).
б) Zn(OH)2 (цинка гидроксид) + Na2O (натрия оксид) = Na2ZnO2 (диоксоцинкат натрия)+ h3O (вода).ZnO (оксид цинка) + 2NaOH (гидроксид натрия) = Na2ZnO2 (диоксоцинкат натрия) + h3O (вода).
В том случае, если элемент с двойственными свойствами в соединении имеет следующие степени окисления, его двойственные (амфотерные) свойства наиболее заметно проявляются в промежуточной стадии окисления.
Как пример можно привести хром (Cr). Этот элемент имеет следующие степени окисления: 3+, 2+, 6+. В случае +3 основные и кислотные свойства выражаются приблизительно в одинаковой степени, в то время как у Cr +2 преобладают основные свойства, а у Cr +6 - кислотные. Вот реакции, доказывающие данное утверждение:
Cr+2 → CrO (оксид хрома +2), Cr(OH)2 → CrSO4;Cr+3 → Cr2O3 (оксид хрома +3), Cr(OH)3 (хрома гидроксид) → KCrO2 или же хрома сульфат Cr2(SO4)3; Cr+6 → CrO3 (оксид хрома +6), h3CrO4 → K2CrO4.
В большинстве случаев амфотерные оксиды химических элементов со степенью окисления +3 существуют в мета-форме. Как пример, можно привести: метагидроксид алюминия (хим. формула AlO(OH) и метагидроксид железа (хим. формула FeO(OH)).
Как получают амфотерные оксиды?
1. Наиболее удобный метод их получения заключается в осаждении из водного раствора с использованием гидрата аммиака, то есть слабого основания. Например:Al(NO3)3 (нитрат алюминия) + 3(h3OxNh4) (водный раствор аммиака гидрата) = Al(OH)3 (амфотерный оксид) + 3Nh5NO3 (реакция выполняется при двадцати градусах тепла).Al(NO3)3 (нитрат алюминия) + 3(h3OxNh4) (водный раствор гидрата аммиака) = AlO(OH) (амфотерный оксид) + 3Nh5NO3 + h3O (реакция осуществляется при 80 °C)
При этом в обменной реакции этого типа в случае избытка щелочей гидроксид алюминия не будет осаждаться. Это происходит по причине того, что алюминий переходит в анион из-за своих двойственных свойств: Al(OH)3 (алюминия гидроксид) + OH− (избыток щелочей) = [Al(OH)4]− (анион гидроксида алюминия).
Примеры реакций данного типа:Al(NO3)3 (нитрат алюминия) + 4NaOH(избыток гидроксида натрия) = 3NaNO3 + Na(Al(OH)4). ZnSO4 (сульфат цинка) + 4NaOH(избыток гидроксида натрия) = Na2SO4 + Na2(Zn(OH)4).
Соли, которые при этом образуются, относятся к комплексным соединениям. Они включают в себя следующие анионы комплексные: (Al(OH)4)− и еще (Zn(OH)4)2−. Вот так называются эти соли: Na(Al(OH)4) - натрия тетрагидроксоалюминат, Na2(Zn(OH)4) - натрия тетрагидроксоцинкат. Продукты взаимодействия алюминиевых или цинковых оксидов с щелочью твердой называются по-другому: NaAlO2 - натрия диоксоалюминат и Na2ZnO2 - натрия диоксоцинкат.
fb.ru